
| A. | 金属铯的熔点比金属钠高 | B. | CsOH比NaOH的碱性强 | ||
| C. | Cs与H2O能剧烈反应,但没有钠剧烈 | D. | 碳酸铯难溶于水 |
科目:高中化学 来源: 题型:解答题

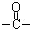 )外,含有的官能团名称是碳碳双键、酯基;
)外,含有的官能团名称是碳碳双键、酯基;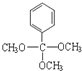 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:| 实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
| A | B | |||
| Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
| Ⅱ | 800℃ | 1.5 mol | 0.5 mol | -- |
| A. | 实验Ⅰ中,10 min内平均速率v(B)=0.06 mol•L-1•min-1 | |
| B. | 上述方程式中a=-160 | |
| C. | 600℃时,该反应的平衡常数是0.45 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果大量苯溶入水中渗入土壤,会对周边农田、水源造成严重污染 | |
| B. | 可以采取抽吸水渠中上层液体的办法,达到部分清除泄漏物的目的 | |
| C. | 由于苯是一种易挥发、易燃的物质,周围地区如果有一个火星就可能引起爆炸 | |
| D. | 事故发生地周围比较空旷,有人提议用点火焚烧的办法来清除泄漏物,会产生大量浓烟,所以该方法未被采纳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 密度:溴苯>H2O>苯 | |
| C. | 含碳量:甲烷>乙烯>乙炔>苯 | |
| D. | 等物质的量燃烧耗O2量:己烷<环己烷<苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 不纯物质 | 处杂试剂 | 分离方法 | |
| A | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙醇(水) | 新制生石灰 | 蒸馏 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
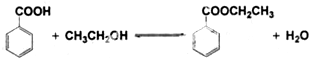
| 名称 | 相对分子质量 | 颜色,状态 | 沸点(℃) | 密度(g•cm-3) |
| 苯甲酸* | 122 | 无色片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
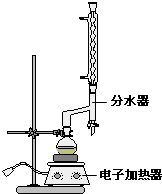
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com