
| A、W2- |
| B、X+ |
| C、Y3- |
| D、Z2- |
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
| A、24g NaH中阴离子所含电子总数为NA |
| B、1mol苯分子中含有3NA个碳碳单键 |
| C、NO2和H2O反应毎生成2mol HNO3时转移的电子数目为2NA |
| D、含0.2 NA个K+的K2SO4固体溶解于1 L水中,所得溶液浓度为0.1mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在常温常压下,11.2LN2含有的分子数为0.5NA |
| B、在常温常压下,1mol氦气含有的原子数为2NA |
| C、71gCl2所含原子数为2NA |
| D、23g钠在化学反应中失去电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、降低温度 |
| B、增大压强 |
| C、使用催化剂 |
| D、减小SO2的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单质硅是将太阳能转化为电能的常用材料 |
| B、硅酸钠的俗名为玻璃,可用于制备硅胶和木材防火剂 |
| C、用浓H2SO4刻蚀工艺玻璃上的纹饰 |
| D、SO2具有氧化性,可用来漂白纸浆 |
查看答案和解析>>
科目:高中化学 来源: 题型:
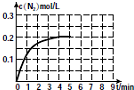 研究化学反应,不仅要关注反应的速率、方向性,还要关注反应进行的限度以及反应过程中的能量变化.
研究化学反应,不仅要关注反应的速率、方向性,还要关注反应进行的限度以及反应过程中的能量变化.| 0 | 1min | 2min | 4min | 5min | |
| 130℃ | 0.50mol | 0.35mol | 0.25mol | 0.10mol | 0.10mol |
| 180℃ | 0.50mol | 0.30mol | 0.18mol | 0.15mol |
| c2(N2)?c2(H2O) |
| c2(NH3)?c(NO)?c(NO2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com