
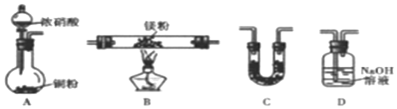
分析 (1)将镁条在空气中点燃后迅速插入盛有CO2气体的集气瓶中,观察到镁条剧烈燃烧,瓶内壁出现黑色固体颗粒生成碳单质和氧化镁白色固体;
(2)①装置A:铜和浓硝酸制取二氧化氮,装置C:干燥二氧化氮,防止水蒸气干扰实验,在加热条件下将Mg和二氧化氮混合,然后再干燥气体,装置B:镁条和二氧化氮反应,装置D:吸收二氧化氮;
②B中充满红棕色气体再开始加热,氮气不溶于水,如果有氮气,则能通过排水法收集到气体;
③装置D中生成两种物质的量相等的钠盐是二氧化氮和氢氧化钠溶液反应生成硝酸钠、亚硝酸钠和水;
(3)①氮化镁和水反应生成氢氧化镁和氨气,氨气能使湿润的红色石蕊试纸变蓝色;
②醋酸铵溶液呈中性,将①中加水后的溶液加热,赶走NH3后,再加入过量的CH3COONH4溶液,根据固体是否溶解分析判断.
解答 解:(1)Mg在CO2中燃烧生成氧化镁和碳,反应的化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO;
(2)①Mg能在NO2中燃烧,产物为Mg3N2、Mg0和N2,装置A中Cu与浓硝酸反应生成的气体NO2,用装置C干燥剂干燥,通入硬质玻璃管B与镁粉发生反应,然后再干燥气体,用D装置除去多余的NO2,故连接装置的顺序为:BCBED,用装置C干燥剂干燥,通入硬质玻璃管B与镁粉发生反应,然后再干燥气体,装置C中的作用是在B的两侧防止水蒸气进入B中与产物Mg3N2反应,可以选择固体氯化钙,
故答案为:C→B→C→D;无水CaCl2;
②当实验过程中出现B中充满红棕色气体现象时,才能开始加热,氮气不溶于水,如果有氮气,则能通过排水法收集到气体,所以确定产物中有N2生成的实验现象为D中试剂瓶中的水被气体压入烧杯中,装置D的NaOH溶液中有气泡逸出,导管出口处为无色无味气体,
故答案为:B中充满红棕色气体; 装置D的NaOH溶液中有气泡逸出,导管出口处为无色无味气体;
③装置D中生成两种物质的量相等的钠盐是二氧化氮和氢氧化钠溶液反应生成硝酸钠、亚硝酸钠和水,反应的离子方程式为:2NO2+2OH-=NO2-+NO3-+H2O,
故答案为:2NO2+2OH-=NO2-+NO3-+H2O;
(3)①取C中少量反应后的固体产物,加入到水中产生有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变成蓝色,证明产物中存在Mg3N2,
故答案为:取C中少量反应产物,加入到水中产生刺激性气味的气体,该气体可使湿润的红色石蕊试纸变蓝;
②NH3•H2O的电离常数与CH3COOH电离常数相等,均为1.75×10-5,所以醋酸铵溶液呈中性,将①中加水后的溶液加热,赶走NH3后,再加入过量的 CH3COONH4溶液,固体溶解,说明MgO和Mg(OH)2溶于铵盐溶液是与NH4+直接反应,不是与NH4+水解出来的H+反应,
故答案为:醋酸铵溶液呈中性,将①中加水后的溶液加热,赶走NH3后,再加入过量的CH3COONH4溶液,根据固体是否溶解分析判断.
点评 本题考查了物质性质的实验探究,理解实验原理、掌握实验基本操作和镁及其化合物性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 正反应速率减小 | B. | 逆反应速率增大 | ||
| C. | 平均相对分子质量不变 | D. | 转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛放NaOH溶液的试剂瓶用磨口玻璃塞 | |
| B. | 氢氟酸保存在塑料瓶中 | |
| C. | 过氧化钠保存在广口瓶中 | |
| D. | 浓盐酸保存在细口试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=2 | |
| B. | 两次平衡的平衡常数相同 | |
| C. | X与Y平衡转化率之比为1:1 | |
| D. | 第二次平衡时,Z的浓度为0.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水提溴时用到热空气将Br2吹出 | B. | 工业制HCl时氯气在氢气中燃烧 | ||
| C. | 硫酸工业中使用到热交换器 | D. | 石油通过分馏得到裂化汽油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com