

| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
| x×x |
| (1-x)×(2-x) |
 ,故答案为:
,故答案为: .
.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
| A、水和冰的混合物,澄清石灰水 |
| B、净化后的空气,氧化镁 |
| C、生锈的铁钉,高锰酸钾充分加热后的剩余固体 |
| D、氯化钾,液氧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 紫外线 |
| A、单位时间内生成2 mol O3,同时消耗3 mol O2 |
| B、O2的消耗速率0.3 mol?L-1?s-1,O3的消耗速率0.2 mol?L-1?s-1 |
| C、容器内,2种气体O3、O2浓度相等 |
| D、气体的密度不在改变. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol HI | 1mol H2+1mol I2 | 2mol HI+1mol H2+1mol I2 |
| HI的浓度(mol?L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 吸收akJ | 放热bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业合成氨的反应,往往需要使用催化剂 |
| B、工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 |
| C、Fe(SCN)3溶液中加入少量固体KSCN后颜色变深 |
| D、实验室用排饱和食盐水的方法收集氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
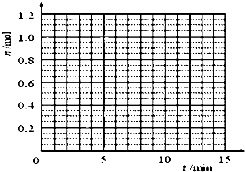
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:
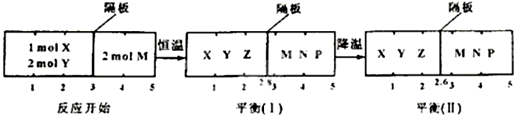
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
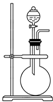 如图是实验室制取某些气体的装置.
如图是实验室制取某些气体的装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com