
| A、150mL1mol?L-1氯化钠溶液 |
| B、75mL1mol?L-1氯化铁溶液 |
| C、150mL2mol?L-1氯化钾溶液 |
| D、75mL2mol?L-1氯化钙溶液 |


科目:高中化学 来源: 题型:
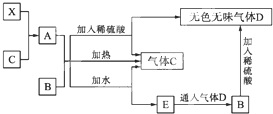
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡向正反应方向移动 |
| B、物质A的转化率增大 |
| C、物质C的体积分数增大 |
| D、m<2n |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol甲苯含有6NA个C-H键 |
| B、25℃,pH=13的NaOH溶液中含有OH-的数目为 0.1NA |
| C、标准状态下,33.6L氟化氢中含有氟原子的数目为1.5NA |
| D、丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1215.9MPa,473K |
| A、等质量白磷的总能量低于黑磷的总能量 |
| B、黑磷与白磷完全燃烧的产物不同 |
| C、白磷转化为黑磷是氧化还原反应 |
| D、白磷转化为黑磷是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将40 gNaOH溶于1L水中,所得NaOH溶液的浓度为1 mol?L-1 | ||
| B、将2.3gNa投入到97.7g水中充分反应,所得溶液中溶质的质量分数为4.0% | ||
C、在t℃时,将a g NH3完全溶液水,得到VmL溶液.该溶液的物质的量浓度为
| ||
| D、1 mol?L-1的硫酸溶液中c(H+)=1 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
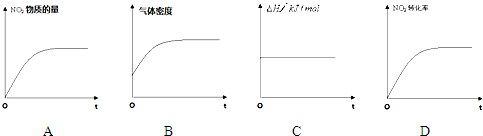
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com