
已知:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C. H2SO4(aq)+
H2SO4(aq)+ Ba(OH)2(aq)===
Ba(OH)2(aq)=== BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
B
【解析】
试题分析:A、燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,则根据方程式可知H2(g)的燃烧热为285.8kJ·mol-1,A错误;B、1g氢气和1g甲醇燃烧放出的热量分别是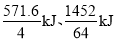 ,所以同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多,B正确;C、由于存在硫酸钡的溶解平衡,溶解吸热,因此反应热不是-57.3 kJ·mol-1,C错误;D、已知:① 2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1,② 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1,则根据盖斯定律可知(①×3—②)÷2得到3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=—131.4 kJ·mol-1,D错误,答案选B。
,所以同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多,B正确;C、由于存在硫酸钡的溶解平衡,溶解吸热,因此反应热不是-57.3 kJ·mol-1,C错误;D、已知:① 2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1,② 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1,则根据盖斯定律可知(①×3—②)÷2得到3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=—131.4 kJ·mol-1,D错误,答案选B。
考点:考查反应热的有关判断、应用与计算


科目:高中化学 来源:2014-2015学年河北省邯郸市高三上学期1月教学质量检测化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.大理石溶于醋酸:CaCO3+2H+ = Ca2++CO2↑+H2O
B.FeBr2溶液中通入少量的Cl2:Cl2+2Fe2+ = 2Fe3++2Cl-
C.向澄清石灰水中通入少量CO2:OH-+CO2 = HCO3-
D.酸性氢氧燃料电池的正极反应:H2-2e- = 2H+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省名校新高考研究联盟高三上学期联考化学试卷(解析版) 题型:推断题
(7分)暗紫色化合物A可作为电极材料的新型超铁电磁,因具有绿色、高电压和高能量的特点,近年来引起了电化学界的高度重视。在常温和干燥的条件下,化合物A可以稳定的存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀。为探究其成分,某学习兴趣小组的同学取化合物A粉末进行试验。经组成分析,该粉末仅含有O、K、Fe三种元素。另取3.96g化合物A的粉末溶于水,滴加足量的稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)3.96 g化合物A中含有Fe元素的物质的量为 mol,含有钾元素的物质的量为 mol。化合物A的化学式为 ;
(2)化合物A与H2O反应的离子方程式为 。
(3)为研究温度对化合物A水溶液稳定性的影响,请设计一个实验方案 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省名校新高考研究联盟高三上学期联考化学试卷(解析版) 题型:选择题
下列现象中,能用键能大小解释的是
A.硝酸易挥发,而硫酸难挥发 B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应 D.氮气的化学性质比氧气稳定
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省红河州高三统一检测理综化学试卷(解析版) 题型:填空题
【化学—选修3:物质结构与性质】(15分)
前四周期元素X、Y、Z、W、R的原子序数依次增大,已知:X原子的2p轨道为半充满状态;Y原子的L层有2个未成对电子;Z与Y位于同主族;W的+2价简单离子核外电子层排布与Ar原子相同;R原子的d轨道上有3个空轨道。请回答下列问题:
(1)R原子的基态电子排布式为 。
(2)X、Y原子的第一电离能大小顺序为 。(用元素符号表示)
(3)X的常见单质分子结构中σ键数目为 。
(4)Z的最高价氧化物对应水化物的酸根离子空间构型为 ,中心原子的杂化轨道类型为 。
(5)某矿物晶体由Y、W、R三种元素组成,其晶胞结构如图所示。

则该矿物的化学式为 ,若已知该晶胞的边长为a cm,则该晶胞的密度为 g/cm3。(用含a、NA的代数式表示)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省红河州高三统一检测理综化学试卷(解析版) 题型:选择题
某苯的衍生物,含有两个互为对位的取代基,其分子式为C8H10O,其中不跟NaOH溶液反应的衍生物种类有
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省部分高三1月份统一考试理综化学试卷(解析版) 题型:填空题
(14分)I.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)

(1)上图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式_________________________________________。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g) 2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表:
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请完成下列问题。
①试比较K1、K2的大小,K1___________K2(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是______________(填序号字母):
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,当测得NH3和N2、H2的物质的量分别为1mol和2mol、3mol时,则该反应的v(N2)正______________v(N2)逆(填写“>”、“=”或“<”)。
II.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb)。
酸或碱 | 电离平衡常数(Ka或 Kb) |
CH3COOH | 1.8×10-5 |
HNO2 | 4.6×10-4 |
HCN | 5×10-10 |
HClO | 3×10-8 |
NH3·H2O | 1.8×10-5 |
请回答下列问题:
(1)上述四种酸中,酸性最弱的是_________________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是_________________(填序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈____(选填“酸性”“中性”或“碱性”),理由是:__________________________,溶液中各离子浓度大小的关系是__________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市崇明县高三上学期期末考试化学试卷(解析版) 题型:选择题
将盛有12mL NO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积是
 A.1.2mL B.2.4mL C.3.6mL D.4.8mL
A.1.2mL B.2.4mL C.3.6mL D.4.8mL
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三元月模拟测试化学试卷(解析版) 题型:选择题
下列物质中含有共价键的离子化合物是
①MgF2 ②Na2O2 ③NaOH ④CO2 ⑤NH4Cl ⑥H2O2 ⑦N2
A.②③④⑤ B.②③⑤ C.①②③⑤ D.①③⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com