
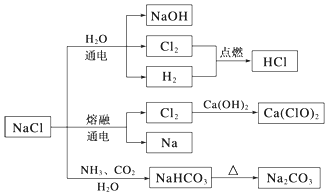
| A. | 由氯化钠制备纯碱的过程中,利用了物质溶解度的差异 | |
| B. | 用Cl2制备漂白粉时,是将Cl2通入澄清石灰水中 | |
| C. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| D. | 图示转化反应都是氧化还原反应 |
分析 A、由转化可知,氯化钠溶液与氨气、二氧化碳反应析出碳酸氢钠;
B、根据工业生产量大,所以Cl2制备漂白粉时,是将Cl2通入石灰乳中;
C、铁能在氯气中燃烧生成棕黄色的烟FeCl3;
D、根据元素的化合价是否变化判断.
解答 解:A、由转化可知,氯化钠溶液与氨气、二氧化碳反应析出碳酸氢钠晶体,则说明25℃时,NaHCO3在水中的溶解度比Na2CO3的小,所以由氯化钠制备纯碱的过程中,利用了物质溶解度的差异,故A正确;
B、因为工业生产量大,所以Cl2制备漂白粉时,是将Cl2通入石灰乳中,不是通入澄清石灰水中,故B错误;
C、Fe与干燥的氯气不反应,则常温下液氯能用钢瓶贮存,但3Cl2+2Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,故C错误;
D、氯化钠和水、氨气、二氧化碳的反应以及碳酸氢钠的分解反应都不是氧化还原反应,故D错误.
故选A.
点评 本题考查物质的性质及相互转化,为高频考点,把握图中转化发生的反应及氧化还原反应的应用为解答的关键,侧重分析与迁移应用能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 在2L密闭容器内,80℃时反应:2NO(g)+O2(g)?2NO2(g),反应体系中,n(NO)随时间t的变化如表
在2L密闭容器内,80℃时反应:2NO(g)+O2(g)?2NO2(g),反应体系中,n(NO)随时间t的变化如表| 时间t(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(A)=0.6 mol/(L•s) | B. | υ(B)=0.2 mol/(L•s) | C. | υ(C)=0.8 mol/(L•s) | D. | υ(D)=1mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用无磷洗衣粉,以减少水体富营养化 | |
| B. | PM2.5是指大气中直径接近于2.5μm(1m=106μm=109nm)的颗粒物,也称可吸入颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体 | |
| C. | 为提高农作物产量大量使用农药和化肥 | |
| D. | 对农作物秸秆进行焚烧还田,以增加土壤肥力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的分解速率和Y的生成速率相等 | |
| B. | 单位时间内生成nmolZ,同时生成nmolX | |
| C. | 反应体系的总质量保持不变 | |
| D. | X、Y、Z的浓度不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com