
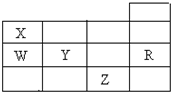
| A. | 常压下Z的单质沸点最高 | B. | 电负性W小于Y | ||
| C. | W的氢化物比X的氢化物稳定 | D. | R的单质在固态时属于原子晶体 |
分析 由元素在周期表中位置,可知X为氮,W为磷,Y为硫,Z为Br,R为Ar.
A.根据单质的状态进行判断;
B.同周期自左而右电负性增大;
C.非金属性越强,氢化物越稳定;
D.稀有气体在固态为分子晶体.
解答 解:由元素在周期表中位置,可知X为氮,W为磷,Y为硫,Z为Br,R为Ar.
A.常温下氮气、氩为气体,磷、硫为固体,而溴为液,故溴的沸点不是最高的,故A错误;
B.同周期自左而右电负性增大,故电负性W小于Y,故B正确;
C.非金属性X>W,非金属性越强,氢化物越稳定,故氢化物稳定性X>W,故C错误;
D.稀有气体Ar在固态为分子晶体,故D错误,
故选B.
点评 本题考查元素周期表与元素周期律,难度不大,注意对元素周期律的理解掌握.


科目:高中化学 来源: 题型:解答题
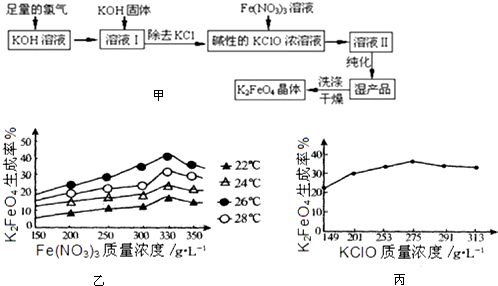
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案(不要求写出具体操作过程) | 预期的实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
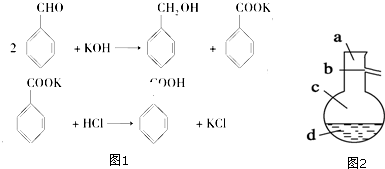
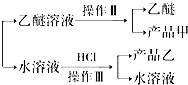
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| A2D | 187 | 202 | 2.6 |
| A2C2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>C>D>B | B. | A>B>C>D | C. | C>A>D>B | D. | C>B>D>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 1:3 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com