
���� ��1����ԭ��ص������͵��ص��������Եõ�������
��װ��Ϊԭ��أ�����dװ�ñ�������X���ĵ缫����Ӧ�������ã�
��2������������þ�������������ܽ�ƽ���Լ��ܶȻ�����ʽ�������ֳ�����������Һ��pH=8ʱ��
c��Mg2+��=$\frac{K{\;}_{sp}}{c��OH{\;}^{-}��{\;}^{2}}$=$\frac{5.61��10{\;}^{-12}}{10{\;}^{-12}}$�T5.61mol/L��
c��Fe3+��=$\frac{K{\;}_{sp}}{c��OH{\;}^{-}��^{3}}$=$\frac{2.64��10{\;}^{-39}}{10{\;}^{-18}}$=2.64��10-21mol/L���㣻
��3����Fe2O3��s��+3C��ʯī��=2Fe��s��+3CO��g����H1=+489.0kJmol-1
��C��ʯī��+CO2��g��=2CO��g����H2=+172.5kJmol-1
���ݸ�˹���ɢ�-�ڡ�3����õ���
��� �⣺��1����װ����ԭ��ص������͵��ص��������Եõ�������
�ʴ�Ϊ��bc��
��װ��Ϊԭ��أ�����dװ�ñ�������X���ĵ缫����Ӧ�������ÿ���ѡ��п��
�ʴ�Ϊ��п��
��2������������þ�������������ܽ�ƽ���Լ��ܶȻ�����ʽ�������ֳ�����������Һ��pH=8ʱ��
c��Mg2+��=$\frac{K{\;}_{sp}}{c��OH{\;}^{-}��{\;}^{2}}$=$\frac{5.61��10{\;}^{-12}}{10{\;}^{-12}}$�T5.61mol/L��
c��Fe3+��=$\frac{K{\;}_{sp}}{c��OH{\;}^{-}��^{3}}$=$\frac{2.64��10{\;}^{-39}}{10{\;}^{-18}}$=2.64��10-21mol/L��
���� c��Mg2+����c��Fe3+��=5.61��2��64��10-21=2.215��1021��
�ʴ�Ϊ��2.215��1021��
��3����Fe2O3��s��+3C��ʯī��=2Fe��s��+3CO��g����H1=+489.0kJmol-1
��C��ʯī��+CO2��g��=2CO��g����H2=+172.5kJmol-1
���ݸ�˹���ɢ�-�ڡ�3�õ�
Fe2O3��s��+3CO��g��?2Fe��s��+3CO2��g����H=-28.5kJmol-1
a=-28.5��
�ʴ�Ϊ��-28.5��
���� ���⿼�����Ȼ�ѧ����ʽ��˹���ɼ���Ӧ�ã�ԭ���ԭ���ķ����жϣ��ܶȻ������ļ��㣬��Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
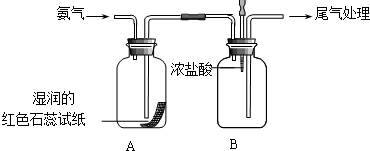 ijС��ͬѧ������ͼ��ʾװ��̽�����������ʣ�
ijС��ͬѧ������ͼ��ʾװ��̽�����������ʣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��a������b��ϡ���ᣨ��������a������c��Һ�У���a��b��Ӧ�����ӷ���ʽΪFe+4H++NO3-=Fe3++NO��+2H2O | |
| B�� | ��c��dΪ���壬�Ҷ���ʹ����ʯ��ˮ����ǣ��˻������ͨ����ˮ�У���ɫ��ȥ������ɫ���̵����ӷ���ʽΪSO2+Br2+2H2O�T4H++SO${\;}_{4}^{2-}$+2Br- | |
| C�� | ��c����ɫ�̼�����ζ�����壬��ˮ��Һ�������ԣ��ڱ�״�������ſ������ռ�c�����ƽ��Ħ������Ϊ20 g��mol-'1�Ļ�����������Ȫʵ�飮�������ʲ���ɢ��ʵ����ɺ�������Һ�����ʵ���Ũ��ԼΪ0�� 056 mol��L-1 | |
| D�� | ��a���������ЧӦ����Ҫ����֮һ��c��d��Ϊ���Σ��μӷ�Ӧ��a��b���ʵ���֮��Ϊ4��5����������Ӧ�����ӷ���ʽΪ4CO2+5OH-�TCO${\;}_{3}^{2-}$+3HCO${\;}_{3}^{-}$+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̼��������ᷴӦ��CO32-+2H+=CO2��+H2O | |
| B�� | ������������Һ��ͨ�������̼��2OH-+CO2=CO32-+H2O | |
| C�� | ����ʯ��ˮ��ϡ���ᷴӦ��Ca ��OH��2+2H+=Ca2++2H2O | |
| D�� | ������������ͭ��Һ�У�Fe+3Cu2+=2Fe3++3Cu |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ٺ͢� | B�� | �ں͢� | C�� | �ۺ͢� | D�� | �ٺ͢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ijʵ��С����0.50mol/L NaOH��Һ��0.50mol/L������Һ�����к��ȵIJⶨ��
ijʵ��С����0.50mol/L NaOH��Һ��0.50mol/L������Һ�����к��ȵIJⶨ��| ʵ�����] | ��ʼ�¶�t1/��C] | ��ֹ�¶�t2/��C] | �¶Ȳ�ƽ��ֵ��t2-t1��/��C] | ||
| H2SO4 | NaOH | ƽ��ֵ | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
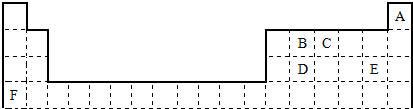
 ���Ƚ�E��F�����ּ����ӵİ뾶��С��E-���ڣ�����ڻ�С�ڣ�F+
���Ƚ�E��F�����ּ����ӵİ뾶��С��E-���ڣ�����ڻ�С�ڣ�F+�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ | B�� | �ɱ� | C�� | �ƾ� | D�� | ���ᱵ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com