
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
A. 常温常压下,11.2L CO2所含的原子数为1.5NA
B. 标准状况下,22.4L H2和N2的混合物中所含原子数为NA
C. 标准状况下,11.2L SO3 中含有2NA个原子
D. 3mol单质Fe完全转变为Fe3O4,失去8NA个电子
【答案】D
【解析】
A.因为不知道常温常压下气体摩尔体积,无法计算11.2LCO2的物质的量,所以无法确定11.2LCO2所含的原子数,A项错误;
B.因为标准状况下气体摩尔体积是22.4L/mol,所以22.4LH2和N2的混合气体物质的量为1mol,而H2和N2的分子中都含有2个原子,所以1mol混合气体含有2mol原子,即22.4L H2和N2的混合物中所含原子数为2NA,B项错误;
C.标准状况下的SO3是固体,无法计算11.2LSO3的物质的量,所以无法确定其中所含有的原子数,C项错误;
D.Fe3O4中铁元素的平均价态为![]() ,3mol单质Fe失去的电子物质的量=(
,3mol单质Fe失去的电子物质的量=(![]() -0)×3mol=8mol,即失去8NA个电子,D项正确;答案选D。
-0)×3mol=8mol,即失去8NA个电子,D项正确;答案选D。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】下列计算结果正确是
A. 0.5L、8mol/L 浓盐酸与足量MnO2完全反应产生22.4L(标准状况下)Cl2
B. 2H2S+SO2=3S↓+2H2O反应中氧化产物与还原产物的物质的量之比为1:2
C. 将NO2和O2等体积混合充满一试管,倒置于水槽中,充分反应后,试管中剩余气体占试管容积的1/8
D. 标准状况下,用一充满HCl气体的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内盐酸的物质的量的浓度为(1/22.4)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向体积为 10 mL 的 0.1 mol/LNaOH溶液中逐滴加入0.1mol/LCH3COOH溶液,曲线如图所示。下列有关离子浓度关系的比较中,错误的是
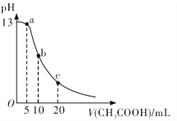
A. a点处:c( Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. b点处:c(CH3COOH)+c(H+ )=c(OH-)
C. c点处:c(CH3COOH)+c(CH3COO-)=2c(Na+)
D. NaOH溶液和CH3COOH溶液以任意比混合时:c( Na+)+c(H+)=c(OH-)+(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,其中N的化合价为________,是_____________(用“电解质”或者“非电解质”填空)。NaN3受热分解产生N2和Na,则该反应方程式为: ________。已知常温常压下气体摩尔体积为24.5L/mol,则在常温常压下,反应130g NaN3能产生_____________L的N2。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为________________(已知该反应为置换反应)。若已知2.3gNa完全反应,转移的电子物质的量为____________。
(3)KClO4是助氧化剂,反应过程中与Na作用生成KC1和Na2O,请用单线桥表示该反应电子转移:KClO4+8Na= KCl+4Na2O_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向硫酸铜溶液中加入一小块金属钠后,观察到的现象有
①钠浮于液面上 ②熔化成小球 ③发出嘶嘶的响声,放出气体
④钠周围蓝色沉淀部分变黑 ⑤有蓝色沉淀产生 ⑥析出大量红色的铜
⑦小球在溶液中沉浮 ⑧小球在液面上游动、逐渐变小,直至消失
A. ①②③④⑤⑥ B. ①②③④⑤⑧ C. ①②③⑥⑧ D. ②⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是
A. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B. 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O![]()
![]() +OH
+OH
C. 由Na和C1形成离子键的过程:![]()
D. 电解精炼铜的阴极反应:Cu2+ +2e![]() Cu
Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烯雌酚(结构简式如图所示》,是一种激素类药物。下列叙述正确的是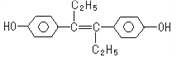
A. 己烯雌酚分子式为C18H12O2
B. 己烯雌酚与NaOH溶液、NaHCO3溶液均能反应
C. 1mol己烯雌酚最多能与4mol溴发生反应
D. 己烯雌酚可以发生加成反应,取代反应、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学设计如图装置:


回答下列问题:
(1)乙中铜片为________极 (填“正”或“负”),其电极反应式为________。
(2)一段时间后,将甲和乙两池溶液混合,加入H2O2和一定量稀硫酸后,有Fe(OH)3沉淀出现,但没有Cu(OH)2沉淀出现,此时溶液中c(Fe3+)=2.6×10-18 mol·L-1,求溶液中Cu2+的最大物质的量浓度________。(写出计算步骤)(已知2Fe2++H2O2+2H+=2Fe3++2H2O,Ksp[Fe(OH)3]=2.6×10-39,Ksp[Cu(OH)2]=2.2×10-20)。
(3)丙中电源的A极为________极(填“正”或“负”)。
(4)若丙池盛放足量的CuSO4溶液:
①在丙池铁棒这极的现象是________。
②在丙池中阳极的电极反应是________。
(5)若丙池中盛放滴加少量酚酞的足量的饱和NaCl溶液1L(假设溶液体积电解前后无变化)。
①丙池通电一段时间后,________极附近溶液呈红色(填Fe或C),总反应的离子方程式:________。
②25℃时,当丙池中有0.1mol电子发生转移时切断电源,则理论上标准状况下共有________ L气体生成。此时溶液的pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时向20mL0.1mol·L-1MOH 溶液中滴加0.1mol·L-1CH3COOH溶液,所得溶液的pH 及导电能力变化如图所示,下列叙述正确的是( )
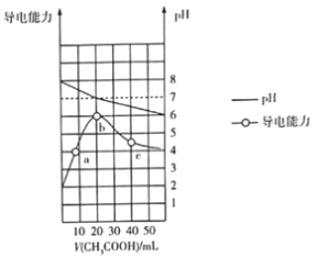
A. MOH 是强电解质
B. b点对应的盐不水解
C. c 点溶液中:c(CH3COO-)>c(M+)>c(H+)>c(OH-)
D. a 点溶液中:c(OH-)+c(CH3COO-)+)+c(M+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com