
 氨和硝酸都是重要的化学品.
氨和硝酸都是重要的化学品.分析 (1)氨催化氧化法合成硝酸的反应原理是氨气催化氧化生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,二氧化氮溶于水生成硝酸和一氧化氮;
(2)向饱和氯化钠和浓氨水的混合溶液中通入过量CO2从而析出NaHCO3晶体,得到氯化铵溶液;在0.1mol/L的稀氨水中存在电离平衡和化学平衡,NH3+H2O?NH3•H2O?NH4++OH-,溶液中存在物料守恒和电荷守恒,据此分析;
(3)A是中学化学常见气体,打开装有A的集气瓶,瓶口出现白雾,将A与氨气混合,立即出现大量白烟为氯化铵固体颗粒,A气体为HCl气体,氯化铵为离子化合物;
(4)设NO和NO2的物质的量分别为xmol、ymol,根据二者总体积、电子转移守恒列方程,再根据在相同状态下,气体的体积之比等于物质的量之比来求算;根据守恒,硝酸的物质的量为:2n(Cu)+n(NO)+n(NO2)‘
(5)向含4mol HNO3的稀溶液中,逐渐加入铁粉至过量,发生的反应为Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,Fe+2Fe(NO3)3=3Fe(NO3)2,生成气体最大为1mol,消耗铁1mol,据此画出图象;
(6)硝酸铵中含有氮、氢、氧三种元素,根据质量守恒定律中元素种类不变的特点可知生成的另一种氧化物中含有氢元素,即该氧化物是水,因此硝酸铵在撞击条件下反应生成一氧化二氮和水.
解答 解:(1)氨催化氧化法合成硝酸的反应原理是氨气催化氧化生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,二氧化氮溶于水生成硝酸和一氧化氮,流程图为:NH3$→_{高温O_{2}}^{催化剂}$NO$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3,
故答案为:NH3$→_{高温O_{2}}^{催化剂}$NO$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3;
(2)向饱和氯化钠和浓氨水的混合溶液中通入过量CO2从而析出NaHCO3晶体,得到氯化铵溶液,反应的化学方程式为:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl,
在0.1mol/L的稀氨水中存在电离平衡,
A.溶液中存在物料守恒即氮元素守恒,c(NH3•H2O)+c(NH3)+c(NH4+)=0.1mol/L,故A正确;
B.溶液中溶质主要是一水合氨,一水合氨存在化学平衡和电离平衡,NH3+H2O?NH3•H2O?NH4++OH-,c(NH3•H2O)>c(NH3)+c(NH4+),故B正确;
C.一水合氨电离NH3•H2O?NH4++OH-,是弱碱c(H+)<c(OH-),故C错误;
D.溶液中存在电荷守恒,c(NH4+)+c(H+)=c(OH-),故D正确;
故答案为:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl; ABD;
(3)A是中学化学常见气体,打开装有A的集气瓶,瓶口出现白雾,将A与氨气混合,立即出现大量白烟为氯化铵固体颗粒,NH3+HCl=NH4Cl,A气体为HCl气体,氯化铵为离子化合物,铵根离子中含极性共价键、配位键,铵根离子和氯离子间形成离子键,
故答案为:HCl;极性共价键、离子键、配位键;
(4)6.4g铜的物质的量为$\frac{6.4g}{64g/mol}$=0.1mol,在反应中失去的电子的物质的量为2×0.1mol=0.2mol,3.36L混合气体的物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol
令NO和NO2的物质的量分别为xmol、ymol,则:
x+y=0.15mol ①
3x+y=0.1mol×2 ②
解得x=0.025,y=0.125,
在相同状态下,气体的体积之比等于物质的量之比,故生成的NO和NO2的体积之比为0.025:0.125=1:5,
根据元素守恒,硝酸的物质的量为:2n(Cu)+n(NO)+n(NO2)=0.1mol×2+$\frac{1}{6}$×0.15mol+$\frac{5}{6}$×0.15=0.35mol,
故答案为:1:5;0.35;
(5)向含4mol HNO3的稀溶液中,逐渐加入铁粉至过量,发生的反应为Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,Fe+2Fe(NO3)3=3Fe(NO3)2,生成气体最大为1mol,消耗铁1mol,n(气体)随n(Fe)变化的图象为: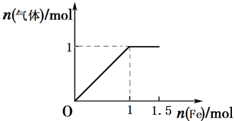 ,
,
故答案为:
(6)硝酸铵中含有氮、氢、氧三种元素,根据质量守恒定律中元素种类不变的特点可知生成的另一种氧化物中含有氢元素,即该氧化物是水,因此硝酸铵在撞击条件下反应生成一氧化二氮和水,该反应的化学方程式为:NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O.
故答案为:NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O.
点评 本题考查了氮及其化合物性质,氧化还原反应电子守恒计算,图象绘制等知识,掌握基础是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:推断题
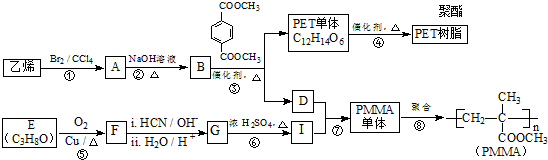
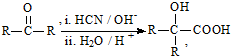 (R、R′代表烃基)
(R、R′代表烃基) .
. .
. .
.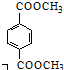 与足量NaOH溶液反应时,最多消耗4molNaOH
与足量NaOH溶液反应时,最多消耗4molNaOH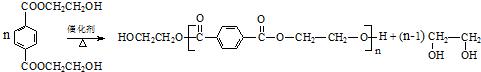 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a、b | B. | b、c | C. | a、d | D. | b、d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | L层上的电子数为奇数的元素一定是主族元素 | |
| B. | 族序数等于周期序数的元素一定是金属元素 | |
| C. | 由不同种元素组成的多原子分子里,一定只存在极性键 | |
| D. | 共价化合物只含有共价键,离子化合物只含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、CO2性质相似,都能在水溶液中被氯气氧化 | |
| B. | Na2O2、Na2O组成元素相同,与CO2反应产物也相同 | |
| C. | Mg和K在一定条件下与水反应都生成H2和对应的碱 | |
| D. | Na、Li同属于碱金属单质,在加热条件下与氧气反应都生成过氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图所示的装置.
氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图所示的装置.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验;请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验;请完成下列填空:| 滴定次数 | 待测盐酸的体积(mL) | 标准NaOH溶液体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 20.00 | 0.40 | 20.50 |
| 第二次 | 20.00 | 4.10 | 24.00 |
| 第三次 | 20.00 | 1.00 | 24.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com