
【题目】研究![]() 、
、![]() 、
、![]() 等的处理方法对环境保护有重要意义。
等的处理方法对环境保护有重要意义。
(1)科学家正在研究利用催化技术将尾气中的NO和CO转变成![]() 和
和![]() ,其反应为:
,其反应为:![]()
![]()
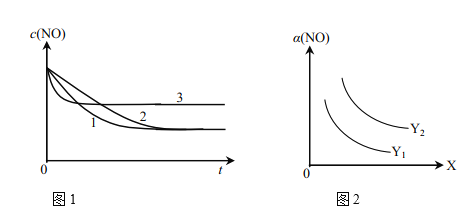
①为了研究外界条件对该反应的影响,进行下表三组实验,测得不同时刻NO的浓度(c)随时间变化的趋势如图1所示。1、2、3代表的实验编号依次是________。(已知在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。)
实验温度NO初始浓度O初始浓度催化剂比表面积催化剂用量编号(℃)
实验 编号 | 温度 (℃) | NO初始浓度
| CO初始浓度
| 催化剂比表面积
| 催化剂用量 (g) |
Ⅰ | 280 |
|
| 82 | 50 |
Ⅱ | 280 |
|
| 124 | 50 |
Ⅲ | 350 |
|
| 124 | 50 |
②图2表示NO的平衡转化率(a)随温度、压强变化的示意图。X表示的是________,理由是________;Y表示的是________,且Y1________Y2(填“>”或“<”)。
(2)一定温度下,将![]() 与
与![]() 以体积比1:2置于密闭容器中发生反应
以体积比1:2置于密闭容器中发生反应![]() ,达到平衡时
,达到平衡时![]() 的体积分数为25%。该反应的平衡常数
的体积分数为25%。该反应的平衡常数![]() ________。
________。
(3)利用原电池反应可实现![]() 的无害化,总反应为
的无害化,总反应为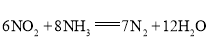 ,电解质溶液为碱性。工作一段时间后,该电池负极区附近溶液pH________(填“变大”、“变小”或“不变”),正极电极反应式为________。
,电解质溶液为碱性。工作一段时间后,该电池负极区附近溶液pH________(填“变大”、“变小”或“不变”),正极电极反应式为________。
【答案】Ⅱ、Ⅰ、Ⅲ 温度 该反应为放热反应,温度升高平衡向左移动,![]() 降低:该反应为气体分子数减小的反应,压强增大,平衡向右移动,
降低:该反应为气体分子数减小的反应,压强增大,平衡向右移动,![]() 增大 压强 < 1.8 变小
增大 压强 < 1.8 变小 
【解析】
(1)①根据温度和催化剂对反应速率的影响及平衡的移动,结合图象和表格来判断;
②反应为气体分子数减少的反应,增大压强,有利于反应正向进行,结合反应的焓变分析温度变化对化学平衡的影响;
(2)设NO2与SO2的物质的量分别为1mol、2mol,容器体积为1L,则
NO2(g)+SO2(g)SO3(g)+NO(g)
开始 1 2 0 0
转化 x x x x
平衡 1-x 2-x x x
达到平衡时SO3的体积分数为25%,则
![]()
解得x=0.75mol/L,
结合K为生成物浓度幂之积与反应物浓度幂之积的比计算。
(3)正极上是二氧化氮得到电子发生还原反应,负极上是氨气失电子发生氧化反应,结合电极反应分析判断。
①温度越高,反应速率越快,催化剂能改变反应速率,但不改变平衡状态,由图1可知,反应3的速率最快,反应1的速率比反应2的速率快,达到平衡时反应物的转化率相同,图表中反应Ⅲ的温度最高且催化剂的表面积最大,则反应3为Ⅲ,而Ⅱ与Ⅰ比较温度相同,但Ⅱ催化剂的表面积大,即Ⅱ的反应速率比Ⅰ快,但平衡状态相同,可知反应1为Ⅱ,反应2为Ⅰ,
故答案为Ⅱ、Ⅰ、Ⅲ;
②反应为气体分子数减少的反应,增大压强,有利于反应正向进行,反应焓变△H<0,正反应放热,降低温度有利于反应正向进行,当反应逆向进行时,NO转化率降低,则可采取的措施有升高温度或降低压强,因此条件为温度,则Y表示压强,控制温度相同时,压强越大,NO转化率越高,则Y1<Y2,
故答案为温度;该反应为放热反应,温度升高,平衡向左移动,α(NO)降低;该反应为气体分子数减小的反应,压强增大,平衡向右移动,α(NO)增大;压强;<;
(2)设NO2与SO2的物质的量分别为1mol、2mol,容器体积为1L,则
NO2(g)+SO2(g)SO3(g)+NO(g)
开始 1 2 0 0
转化 x x x x
平衡 1x 2x x x
达到平衡时SO3的体积分数为25%,则![]() ,解得x=0.75mol/L,
,解得x=0.75mol/L,
该反应的平衡常数![]() ,
,
故答案为1.8;
(3)原电池工作时,负极发生氧化反应,正极发生还原反应,根据电极总反应6NO2+8NH3=7N2+12H2O,可知正极上是二氧化氮得到电子发生还原反应,电极反应为:2NO2+8e+4H2O=N2+8OH,该电池正极区附近溶液pH增大,
故答案为变大; 2NO2+8e+4H2O=N2+8OH。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】煤炭被人们誉为黑色的“金子”,它是人类使用的主要能源之一。为了提高煤的利用率,减少有害气体的排放,人们采取了各式各样的方法。
(1)煤的气化和液化可能提高煤的利用率。煤的气化技术的主要产物是___________。煤的液化技术又分为直接液化和间接氧化.将煤隔绝空气加强热得到焦炉气、煤焦油及焦炭等产品的技术称为___________。
(2)煤在燃烧前、后及燃烧过程中均可采取措施减少有害气体的排放.
①在燃烧前,可以采用微生物脱硫技术.原理如下:
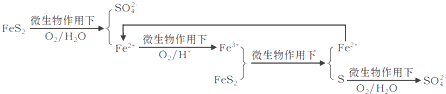
上述过程中Fe2+的作用为________________。写出Fe2+![]() Fe3+的离子方程式________________。
Fe3+的离子方程式________________。
②煤在燃烧时,进行脱硫处理,常采用________燃烧技术,在把煤和脱硫剂加入锅炉燃烧室,使煤与空气在流化过程中充分混合、燃烧,起到固硫作用.常用脱硫剂的主要化学成分为_______(填化学式)。
③煤在燃烧后,烟气净化常采用除尘技术和脱硫、脱硝技术.湿法脱硫、脱硝技术中将烟气通入_________设备,用石灰水淋洗。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解MnSO4溶液制备Mn和MnO2,工作原理如图所示,下列说法不正确的是
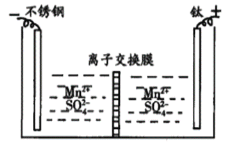
A.阳极区得到H2SO4
B.阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+
C.离子交换膜为阳离子交换膜
D.当电路中有2mole-转移时,生成55gMn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)命名下列有机物:HOCH2CH2CHO_____, ________。
________。
(2)燃烧某有机物A 1.50 g,生成1.12 L(标准状况)CO2和0.05 mol H2O,该有机物的蒸气对空气的相对密度是1.04,则该有机物的分子式为_____。
(3)已知端炔烃在催化剂存在下可发生偶联反应:2RC≡CH![]() RC≡C—C≡CR+H2,称为Glaser反应,回答下列问题:
RC≡C—C≡CR+H2,称为Glaser反应,回答下列问题:
已知: ,该转化关系的产物E(C16H10)的结构简式是_______,用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气____mol。
,该转化关系的产物E(C16H10)的结构简式是_______,用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以钒炉渣(主要含V2O3,还有少量SiO2、P2O5等杂质)为原料可以制备氧钒碱式碳酸铵晶体[(NH4)5(VO)6(CO3)4(OH)9·10H2O],其生产工艺流程如下。

(1)焙烧过程中V2O3转化为可溶性NaVO3,该反应的化学方程式为_________________________________。
(2)滤渣的主要成分是________________(写化学式)。
(3)“沉钒”得到偏钒酸铵(NH4VO3),若滤液中c(VO3-)=0.1mol·L-1,为使钒元素的沉降率达到98%,至少应调节c(NH4+)为____mol·L-1。[已知Ksp(NH4VO3)=1.6×10-3]
(4)“还原”V2O5过程中,生成VOC12和一种无色无污染的气体,该反应的化学方程式为_______________________。用浓盐酸与V2O5反应也可以制得VOC12,该方法的缺点是____________________________。
(5)称量a g产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol·L-1KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知滴定反应为VO2++Fe2++2H+==VO2++Fe3++H2O)
①KMnO4溶液的作用是______________。
②粗产品中钒的质量分数表达式为________(以VO2计)。
③若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果_____(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AgCl的沉淀溶解平衡为AgCl(s)![]() Ag+(aq)+Cl(aq),下列说法中错误的是( )
Ag+(aq)+Cl(aq),下列说法中错误的是( )
A.向AgCl悬浊液中加少量水,c(Ag+)一定减小
B.AgCl饱和溶液中c(Ag+)=![]() mol/L
mol/L
C.用NaCl溶液代替蒸馏水洗涤AgCl沉淀,可以减少沉淀损失
D.反应AgCl+NaBr=AgBr+NaCl易进行,说明溶解度:AgCl>AgBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+ 2H2O(g) ![]() CO2(g)+4H2(g) 已知,破坏1mol化学键需要吸收的热量如下表所示:
CO2(g)+4H2(g) 已知,破坏1mol化学键需要吸收的热量如下表所示:
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | 414 | 464 | 803 | 436 |
试通过计算判断,下列有关甲烷转化成氢气过程的能量变化示意图正确的是
A. 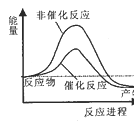 B.
B.  C. C
C. C D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,原因是(用离子方程式表示):___。
(2)调节pH,实验记录如下:
实验序号 | pH | 实验现象 |
a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液。
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应。
该学生对产生的白色沉淀提出了两种假设:
①白色沉淀为Ag2SO3。
②白色沉淀为Ag2SO4,推测的依据是___。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4。实验方法是:另取Ag2SO4固体置于__溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化。
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体。
Ⅲ.分别用Ba(NO3)2、BaCl2溶液检验Ⅱ中反应后的溶液,前者无明显变化,后者产生白色沉淀。
①实验Ⅰ的目的是___。
②根据实验现象分析,X的成分是___。
③Ⅱ中反应的化学方程式是___。
(5)该同学综合以上实验,分析产生X的原因:随着酸性的增强,体系的还原性增强。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O,反应的化学方程式为MnO2+SO2MnSO4。
(1)质量为17.40 g纯净MnO2最多能氧化____L(标准状况)SO2。
(2)已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10-6mol·L-1),需调节溶液pH范围为____。
(3)下图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为____。

(4)准确称取0.171 0 g MnSO4·H2O样品置于锥形瓶中,加入适量H3PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用c(Fe2+)=0.050 0 mol·L-1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00 mL。计算MnSO4·H2O样品的纯度(请给出计算过程)_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com