
| A£® | ¢Ł¢Ū | B£® | ¢Ś¢Ū | C£® | ¢Ś¢Ü | D£® | ¢Ł¢Ü |
·ÖĪö ¢ŁCµÄÅØ¶Č±ä»ÆĪŖ0.6mol/L£¬øł¾Żv=$\frac{”÷c}{”÷t}$¼ĘĖćv£ØC£©£¬øł¾ŻĖŁĀŹÖ®±ČµČÓŚ»Æѧ¼ĘĮæŹżÖ®±Č¼ĘĖćv£ØA£©£»
¢ŚCµÄÅØ¶Č±ä»ÆĪŖ0.6mol/L£¬øł¾Żv=$\frac{”÷c}{”÷t}$¼ĘĖćv£ØC£©£¬øł¾ŻĖŁĀŹÖ®±ČµČÓŚ»Æѧ¼ĘĮæŹżÖ®±Č¼ĘĖćv£ØB£©£»
¢ŪA”¢B»Æѧ¼ĘĮæŹżÖ®±ČĪŖ2£ŗ1£¬²Ī¼Ó·“Ó¦µÄA”¢BµÄĪļÖŹµÄĮæÖ®±ČĪŖ2£ŗ1£¬A”¢BµÄĘšŹ¼ĪļÖŹµÄĮæÖ®±ČĪŖ2£ŗ1£¬Ę½ŗāŹ±ĪļÖŹAÓėBµÄ×Ŗ»ÆĀŹĻąµČ£»
¢Üøł¾ŻCµÄÅØ¶Č±ä»ÆĮæ¼ĘĖćBµÄÅØ¶Č±ä»ÆĮæ£¬Ę½ŗāŹ±ĪļÖŹBµÄÅØ¶ČµČÓŚBĘšŹ¼ÅØ¶Č¼õČ„BµÄÅØ¶Č±ä»ÆĮ森
½ā“š ½ā£ŗ¢ŁCµÄÅØ¶Č±ä»ÆĪŖ0.6mol/L£¬ĖłŅŌv£ØC£©=$\frac{0.6mol/L}{2s}$=0.3mol/£ØL•S£©£¬ĖŁĀŹÖ®±ČµČÓŚ»Æѧ¼ĘĮæŹżÖ®±Č£¬ĖłŅŌv£ØA£©=$\frac{2}{3}$v£ØC£©=$\frac{2}{3}$”Į0.3mol/£ØL•S£©=0.2mol/£ØL•S£©£»¹Ź¢ŁÕżČ·£»
¢ŚÓÉ¢ŁÖŖ£¬v£ØC£©=0.3mol/£ØL•S£©£¬ĖŁĀŹÖ®±ČµČÓŚ»Æѧ¼ĘĮæŹżÖ®±Č£¬ĖłŅŌv£ØB£©=$\frac{1}{3}$v£ØC£©=$\frac{1}{3}$”Į0.3mol/£ØL•S£©=0.1mol/£ØL•S£©£¬¹Ź¢Ś“ķĪó£»
¢ŪA”¢B»Æѧ¼ĘĮæŹżÖ®±ČĪŖ2£ŗ1£¬²Ī¼Ó·“Ó¦µÄA”¢BµÄĪļÖŹµÄĮæÖ®±ČĪŖ2£ŗ1£¬A”¢BµÄĘšŹ¼ĪļÖŹµÄĮæÖ®±ČĪŖ2£ŗ1£¬ÓÉ·½³ĢŹ½2A£Øg£©+B£Øg£©ØT3C£Øg£©æÉÖŖ£¬A”¢B·Ö±š×Ŗ»ÆĮĖ0.4mol/L”Į2L=0.8mol£¬0.2mol/L”Į2L=0.4mol£¬Ę½ŗāŹ±ĪļÖŹAÓėBµÄ×Ŗ»ÆĀŹĻąµČ¶¼ŹĒ$\frac{0.8mol}{2mol}$”Į100%=$\frac{0.4mol}{1mol}$”Į100%=40%£¬¹Ź¢ŪÕżČ·£»
¢Ü”÷c£ØC£©=0.6mol/L£¬øł¾Ż2A£Øg£©+B£Øg£©?3C£Øg£©æÉÖŖ£¬”÷c£ØB£©=$\frac{1}{3}$”÷c£ØC£©=$\frac{1}{3}$”Į0.6mol/L=0.2mol/L£¬ĖłŅŌBĘ½ŗāÅضČĪŖ$\frac{1mol}{2L}$-0.2mol/L=0.3mol/L£¬¹Ź¢Ü“ķĪó£»
¹ŹŃ”A£®
µćĘĄ ±¾Ģāæ¼²é»Æѧ·“Ó¦ĖŁĀŹµÄ¼ĘĖć”¢»ÆŃ§Ę½ŗāµÄÓŠ¹Ų¼ĘĖć£¬ĢāÄæÄѶČÖŠµČ£¬×¢Ņā°ŃĪÕ·“Ó¦ĖŁĀŹŗĶ»ÆŃ§Ę½ŗāµÄ¼ĘĖć·½·Ø£¬²ąÖŲÓŚæ¼²éѧɜµÄ·ÖĪöÄÜĮ¦ŗĶ¼ĘĖćÄÜĮ¦£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
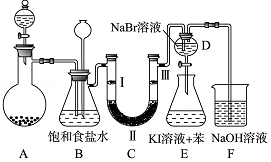 ČēĶ¼ŹĒŹµŃéŹŅÖʱøĀČĘų²¢½ųŠŠŅ»ĻµĮŠĻą¹ŲŹµŃéµÄ×°ÖĆ£Ø¼Š³Ö¼°¼ÓČČŅĒĘ÷ŅŃĀŌ£©£®
ČēĶ¼ŹĒŹµŃéŹŅÖʱøĀČĘų²¢½ųŠŠŅ»ĻµĮŠĻą¹ŲŹµŃéµÄ×°ÖĆ£Ø¼Š³Ö¼°¼ÓČČŅĒĘ÷ŅŃĀŌ£©£® MnCl2+Cl2”ü+2H2O£»
MnCl2+Cl2”ü+2H2O£»| A | B | C | D | |
| ¢ń | øÉŌļµÄÓŠÉ«²¼Ģõ | øÉŌļµÄÓŠÉ«²¼Ģõ | ŹŖČóµÄÓŠÉ«²¼Ģõ | ŹŖČóµÄÓŠÉ«²¼Ģõ |
| ¢ņ | ¼īŹÆ»Ņ | ÅØĮņĖį | ÅØĮņĖį | ĪŽĖ®ĀČ»ÆøĘ |
| ¢ó | ŹŖČóµÄÓŠÉ«²¼Ģõ | ŹŖČóµÄÓŠÉ«²¼Ģõ | øÉŌļµÄÓŠÉ«²¼Ģõ | øÉŌļµÄÓŠÉ«²¼Ģõ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ü¢Ż | B£® | ¢Ł¢Ū¢Ü¢Ż | C£® | ¢Ū¢Ü¢Ż | D£® | ¢Ü¢Ż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğĖÄ“ØŹ”øßŅ»ÉĻ10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
O2ŗĶO3ŹĒŃõŌŖĖŲµÄĮ½ÖÖµ„ÖŹ£¬øł¾ŻĘä·Ö×ÓŹ½Ķź³ÉĻĀĮŠø÷Ģā£ŗ
£Ø1£©ÖŹĮæÖ®ŗĶĪŖ96æĖµÄO2ŗĶO3µÄĘųĢå»ģŗĻ£¬ĘäŃõŌ×ÓøöŹżĪŖ______________”£
£Ø2£©ĻÖŅŖÅäÖĘ1 mol”¤L?1 Na2CO3ČÜŅŗ250 mL£¬Ēó£ŗ¢ŁŠčŅŖ¹ĢĢåNa2CO3_____________g£»¢ŚŠčŅŖŗ¬½į¾§Ė®µÄĢ¼ĖįÄĘ¾§Ģå£ØNa2CO3”¤10 H2O£© g£»¢ŪŠčŅŖĪļÖŹµÄĮæÅضČĪŖ4 mol”¤L?1µÄNa2CO3ČÜŅŗ mL£»¢ÜŠčŅŖČÜÖŹµÄÖŹĮæ·ÖŹżĪŖ12£„”¢ĆܶČĪŖ1£®12 g”¤cm-3µÄNa2CO3ČÜŅŗ mL”£
£Ø3£©ŌŚÅäÖĘÉĻŹöČÜŅŗµÄ¹ż³ĢÖŠ£¬æÉÄܵ¼ÖĀÅäÖĘČÜŅŗÅضČĘ«Š”µÄÓŠ£ŗ_________
A. ¹ĢĢåNa2CO3·ÅŌŚÓŅÅĢ£Ø1 gŅŌĻĀÓĆÓĪĀė£©£»
B. ČŻĮæĘæÓĆĢ¼ĖįÄĘČÜŅŗĻČČóĻ“£»
C. ×ŖŅĘČÜŅŗŹ±Ī“Ļ“µÓÉÕ±£»
D. ¶ØČŻŹ±£¬ČÜŅŗĪ“ĄäČ“£»
E. ¶ØČŻŹ±ŹÓĻßŃöŹÓ£»
F. Ņ”ŌČŹ±£¬·¢ĻÖŅŗĆęµĶÓŚČŻĮæĘææĢ¶ČĻߣ¬µ«Ī“²¹¼ÓĖ®£»
G. ČŻĮæĘæĪ“øÉŌļ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğĖÄ“ØŹ”øßŅ»ÉĻ10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ČēĶ¼×¶ŠĪĘæ֊װĀśĮĖc mol”¤L-1µÄNa2SO4ČÜŅŗ£¬¾²ā¶ØĘäÖŠŗ¬ÓŠa mol SO42-£¬Ōņ׶ŠĪĘæČŻ»żĪŖ£Ø £©

A£®a/c L B£®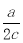 L C£®ac L D£®2ac L
L C£®ac L D£®2ac L
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 1905ÄźµĀ¹ś»Æѧ¼Ņ¹ž²®·¢Ć÷ĮĖŗĻ³É°±µÄ·½·Ø£¬ĖūŅņ“Ė»ńµĆĮĖ1918Äź¶Čŵ±“¶ū»Æѧ½±£®°±µÄŗĻ³É²»½ö½ā¾öĮĖµŲĒņÉĻŅņĮøŹ³²»×ć¶ųµ¼ÖĀµÄ¼¢¶öÓėĖĄĶöĪŹĢā£¬ŌŚ¹ś·Ą”¢ÄÜŌ“”¢Ēį¹¤Ņµ·½ĆęŅ²ÓŠ¹ć·ŗÓĆĶ¾£®
1905ÄźµĀ¹ś»Æѧ¼Ņ¹ž²®·¢Ć÷ĮĖŗĻ³É°±µÄ·½·Ø£¬ĖūŅņ“Ė»ńµĆĮĖ1918Äź¶Čŵ±“¶ū»Æѧ½±£®°±µÄŗĻ³É²»½ö½ā¾öĮĖµŲĒņÉĻŅņĮøŹ³²»×ć¶ųµ¼ÖĀµÄ¼¢¶öÓėĖĄĶöĪŹĢā£¬ŌŚ¹ś·Ą”¢ÄÜŌ“”¢Ēį¹¤Ņµ·½ĆęŅ²ÓŠ¹ć·ŗÓĆĶ¾£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 Ģ¼ŗĶĢ¼µÄ»ÆŗĻĪļŌŚÉś²ś”¢Éś»īÖŠµÄÓ¦ÓĆ·Ē³£¹ć·ŗ£® ĻÖ½«²»Ķ¬ĮæµÄCO2£Øg£©ŗĶH2£Øg£©·Ö±šĶØČėĢå»żĪŖ2LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ£¬½ųŠŠČēĻĀ·“Ó¦£ŗCO2£Øg£©+H2£Øg£©?CO£Øg£©+H2O£Øg£©£¬µĆµ½ČēĻĀČż×鏿¾Ż£ŗ
Ģ¼ŗĶĢ¼µÄ»ÆŗĻĪļŌŚÉś²ś”¢Éś»īÖŠµÄÓ¦ÓĆ·Ē³£¹ć·ŗ£® ĻÖ½«²»Ķ¬ĮæµÄCO2£Øg£©ŗĶH2£Øg£©·Ö±šĶØČėĢå»żĪŖ2LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ£¬½ųŠŠČēĻĀ·“Ó¦£ŗCO2£Øg£©+H2£Øg£©?CO£Øg£©+H2O£Øg£©£¬µĆµ½ČēĻĀČż×鏿¾Ż£ŗ| ŹµŃé×é | ĪĀ¶Č/”ę | ĘšŹ¼Įæ/mol | Ę½ŗāĮæ/mol | “ļµ½Ę½ŗāĖłŠčŹ±¼ä/min | |
| CO2 | H2 | CO | |||
| 1 | 800 | 4 | 2.5 | 1.5 | 5 |
| 2 | 830 | 2 | 2 | 1 | 3 |
| 3 | 830 | 2 | 2 | 1 | 1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ś¢Ž | B£® | ¢Ū¢Ü | C£® | ¢Ł¢Ś¢Ū¢Ü | D£® | ¢Ü¢Ż¢Ž |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | SO2”¢H2S | B£® | SO2”¢NO2 | C£® | CO2”¢NH3 | D£® | SO2”¢Cl2 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com