
| A. |  +HNO3$→_{△}^{浓盐酸}$ +HNO3$→_{△}^{浓盐酸}$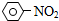 +H2O 取代反应 +H2O 取代反应 | |
| B. | CH2=CH2+Br2→CH2Br CH2Br; 加成反应 | |
| C. | CH3CH2OH+HCl→CH3CH2Cl+H2O; 酯化反应 | |
| D. | 2CH3CH2OH+O2 $→_{△}^{催化剂}$ 2CH3CHO+2H2O; 氧化反应 |
分析 A、有机物分子中的某些原子或原子团被其他原子或原子团所代替的反应称为取代反应;
B、有机物分子中的不饱和键发生断裂,不饱和原子直接与其它原子或原子团相结合,生成新的化合物的反应称为加成反应;
C、酯化反应是醇类与羧酸发生的取代反应;
D、氧化还原反应指有化合价升降的反应.
解答 解:A、苯环上的氢原子被硝基代替,属于取代反应,故A正确;
B、碳碳双键断裂,分别结合氢原子、溴原子,生成CH3-CH2Br,属于加成反应,故B正确;
C、乙醇与HCl反应生成氯乙烷,属于取代反应,故C错误;
D、碳元素、氧元素化合价在反应前后发生变化,属于氧化还原反应,故D正确.
故选C.
点评 本题主要考查了常见有机化学反应类型的判断,根据概念判断,难度不大,注意概念的理解把握.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O | |
| C. | 向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0 的溶液中:Mg2+、Fe3+、NO3-、SO42- | |
| B. | 能使pH试纸变红色的溶液中:Na+、AlO2-、S2-、CO32- | |
| C. | 含有大量Fe3+的溶液:SCN-、I-、K+、Br- | |
| D. | 由水电离出的c(OH-)=1×10-13 mol•L-1的溶液中:NH4+、Al3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:选择题
在2L密闭 容器中,加入X和Y各4mol,一定条件下发生化学反应:
容器中,加入X和Y各4mol,一定条件下发生化学反应:
2X(g)+ 2Y(g) Z(g) + 2 W(g) △H <0, 反应进行到5s时达到化学平衡,测得X的转化率为25%,则下列说法正确的是
Z(g) + 2 W(g) △H <0, 反应进行到5s时达到化学平衡,测得X的转化率为25%,则下列说法正确的是
A.5s时,正、逆反应速率都达到最大
B.前5s 内平均反应速率υ(Y)= 0.1 mol/( L·s)
内平均反应速率υ(Y)= 0.1 mol/( L·s)
C.达平衡时,各物质的浓度都保持不变,反应停止
D.升高温度,测得容器中密度不变时,表示该反应已经达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
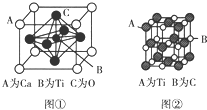 钛已作为常用金属铁、铝后的第三金属,我国钛矿储量丰富,对它的应用研究是目前科学研究的前沿课题之一.
钛已作为常用金属铁、铝后的第三金属,我国钛矿储量丰富,对它的应用研究是目前科学研究的前沿课题之一.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
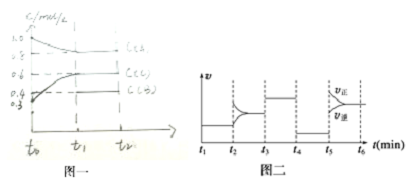
| A. | t4-t5阶段改变的条件为减小压强 | |
| B. | B的起始物质的量为1.0 mol | |
| C. | 在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡(与t1时刻浓度相同),a、b、c要满足的条件为a+$\frac{2c}{3}$=2.4和b+$\frac{c}{3}$=1.2 | |
| D. | 此温度下该反应的化学方程式为2A(g)+B(g)?2C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
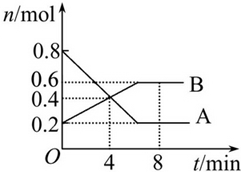 8min时,v(正)=v(逆).
8min时,v(正)=v(逆).查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:选择题
为提高中和热测定的准确性,下列措施不合理的是
A.用两只量筒分别量取所需氢氧化钠和盐酸
B.两溶液混合后,轻轻搅动溶液,准确读取混合溶液的最高温度
C.仪器装置保温隔热的效果要好,且操作动作要迅速
D.所用的氢氧化钠和盐酸溶液的浓度不宜太大,且体积和浓度均相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com