
分析 (1)反应MnO2+4HCl═MnCl2+Cl2↑+2H2O中,Mn元素化合价降低,被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,MnCl2为还原产物;
(2)n(MnO2)=$\frac{21.8g×80%}{87g/mol}$═0.2mol,在MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,每有1mol二氧化锰反应,就会有4molHCl反应,结合c=$\frac{n}{V}$和V=nVm计算求解.
解答 解:(1)反应MnO2+4HCl═MnCl2+Cl2+2H2O中,Mn元素化合价降低,被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,Cl2为氧化产物,氧化剂和还原剂得失电子数目相等,由元素化合价的变化可知转移的电子数目为2,用“双线桥法”表示氧化还原反应中电子转移情况为: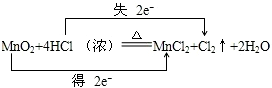 ,
,
故答案为: ;
;
(2)n(MnO2)=$\frac{21.8g×80%}{87g/mol}$═0.2mol,
MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O
1mol 4mol 22.4L
0.2mol 0.8mol 4.48L
①浓盐酸的浓度为:$\frac{0.8mol}{0.08L}$=10mol/L,②标准状况下产生气体的体积为4.48L,答:①浓盐酸的浓度为:10mol/L;②标准状况下产生气体的体积为4.48L.
点评 本题考查了实验室制取氯气的反应原理和根据化学方程式的计算,以及与制取氯气有关的氧化还原反应知识,较为综合,也较为基础,能很好地考查知识和能力.


科目:高中化学 来源: 题型:选择题
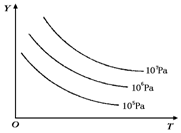 有下列可逆反应:L(s)+G(g)?2R(g)(正反应吸热),外界温度、压强的变化对该反应的影响如图所示:则下列对图中纵坐标Y的含义的有关叙述中正确的是( )
有下列可逆反应:L(s)+G(g)?2R(g)(正反应吸热),外界温度、压强的变化对该反应的影响如图所示:则下列对图中纵坐标Y的含义的有关叙述中正确的是( )| A. | G的转化率 | B. | 平衡混合气中R的体积分数 | ||
| C. | 平衡混合气中G的体积分数 | D. | 平衡混合气中L的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | T | X | Y | Z |
| 性质结构信息 | 原子核外s电子总数等于p电子总数;人体内含量最多的元素,且其单质是常见的助燃剂 | 单质为双原子分子,分子中含有3对共用电子对,常温下单质性质稳定,但其原子较活泼 | 第3周期元素的简单离子中半径最小 | 第4周期元素,M电子层为全充满状态,最外层只有一个电子的原子 |
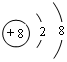 ;写出元素X的气态氢化物的电子式
;写出元素X的气态氢化物的电子式 ;X形成的单质分子,含1个σ键,2个π键.写出Z元素原子的外围电子排布式3d104s1;元素Y的原子核外共有2种形状不同的电子云.
;X形成的单质分子,含1个σ键,2个π键.写出Z元素原子的外围电子排布式3d104s1;元素Y的原子核外共有2种形状不同的电子云.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
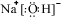 ,并指出其中存在的化学键.离子键和共价键
,并指出其中存在的化学键.离子键和共价键查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ①⑤ | C. | ①②⑤ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了加快过滤速度,可用玻璃棒搅拌过滤器中的液体 | |
| B. | 在蒸馏时应先打开冷凝水开关,待水充满后再点燃酒精灯 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,然后换一个烧杯将上层液体放出 | |
| D. | 在做蒸馏实验时应将温度计的水银球浸没在液体里 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次学段考试化学卷(解析版) 题型:选择题
常温下,1mol化学键分解成气态原子所需要的能量用E表示。根据表中信息判断下列说法不正确的是( )
共价键 | H—H | F—F | H—F | H—Cl | H—I |
E/(kJ·mol-1) | 436 | 157 | 568 | 432 | 298 |
A.432kJ·mol-1>E(H—Br)>298kJ·mol-1
B.表中最稳定的共价键是H—F键
C.H2(g)→2H(g)△H=+436kJ·mol-1
D.H2(g)+F2(g)=2HF(g)△H=-25kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com