
下列叙述正确的是()
A. 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B. 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C. 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH
D. 电解精炼铜时,将粗铜作电解池的阴极,纯铜作电解池的阳极
考点: 原电池和电解池的工作原理.
专题: 电化学专题.
分析: A.原电池的负极失去电子发生氧化反应,正极得到电子发生还原反应;电解池中的阳极失去电子发生氧化反应,阴极得到电子发生还原反应;
B.惰性电极电解Na2SO4溶液,阳极是氢氧根离子失电子生成氧气,阴极是氢离子得到电子生成氢气;
C.惰性电极电解饱和NaCl溶液,阳极氯离子失电子生成氯气,阴极是氢离子得到电子生成氢气,依据电极反应电子守恒计算分析;
D.电解精炼铜时,粗铜作阳极,精铜作阴极.
解答: 解:A、原电池中,负极失电子发生氧化反应,电解池中阴极得到电子发生还原反应,故A错误;
B、惰性电极电解Na2SO4溶液,实质是电解水,阳极是氢氧根离子失电子生成氧气,阴极是氢离子得到电子生成氢气,阴阳两极产物的物质的量之比为2:1,故B错误;
C、惰性电极电解饱和NaCl溶液,阳极氯离子失电子生成氯气,阴极是氢离子得到电子生成氢气,依据电极反应电子守恒计算2H++2e﹣=H2↑,若有1mol电子转移,氢离子减小1mol,溶液中氢氧根离子增加1mol,则生成1mol NaOH,故C正确;
D、电解精炼铜时,粗铜作阳极,精铜作阴极,故D错误;
故选:C.
点评: 本题考查学生原电池和电解池的工作原理以及应用知识,注意知识的归纳和整理是关键,难度中等.


科目:高中化学 来源: 题型:
已知FeS2中铁元素的化合价为+2价,关于反应:4CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4的下列说法正确的是()
A. 该反应的氧化剂只有CuSO4
B. SO42﹣既不是氧化产物也不是还原产物
C. 1 mol CuSO4还原了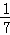 mol的S
mol的S
D. 被还原的S和被氧化的S的质量比为7:3
查看答案和解析>>
科目:高中化学 来源: 题型:
关于物质的分类正确组合是()
分类
组合 酸 碱 盐 氧化物
A H2SO4 Na2CO3 NaHCO3 SiO2
B HCl NaOH NaCl Na2O
C CO2 NaOH MgCl2 SO3
D HNO3 KOH CaO CaCO3
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于实验现象的描述不正确的是()
A. 把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B. 用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌
C. 把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D. 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
如图中X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,如图中符合这一情况的是()
A极板 B极板 X电极 Z溶液
A 锌 石墨 负极 CuSO4
B 石墨 石墨 负极 NaOH
C 银 铁 正极 AgNO3
D 铜 石墨 负极 CuCl2
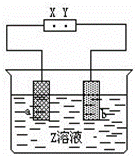
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
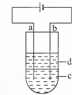
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如下图所示电解实验可制得白色纯净的Fe(OH)2沉淀.两电极的材料分别为石墨和铁.
(1)a电极材料应为 ,电极反应式 ;
(2)电解液c可以是(填编号)
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用为 ,在加入苯之前对c应作怎样的简单处理? .
(4)为了在较短时间内看到白色沉淀,可采取的措施(填编号)
A.改用稀硫酸作电解液
B.适当增大电源的电压
C.适当减少两电极间距离
D.适当降低电解液的温度
(5)若c为Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一明显现象为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知KNO3晶体溶解于水时要吸收热量,从溶液中析出KNO3晶体时会放出热量.若有室温下KNO3饱和溶液20mL,向其中加入1g KNO3晶体,充分搅拌后,下列判断正确的是( )
A. 溶液质量增加 B. 溶液的温度降低
C. 晶体不再溶解 D. 溶液的温度和质量都不变
查看答案和解析>>
科目:高中化学 来源: 题型:
镭是元素周期表中第七周期第ⅡA族元素,关于其叙述不正确的是( )
A. 镭的金属性比钙弱 B. 单质能与水反应生成H2
C. 在化合物中呈+2价 D. 碳酸镭难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某可逆反应m A(g)+n B(气)⇌p C(气)+Q,在密闭容器中进行,右图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线.由曲线分析,下列判断正确的是()
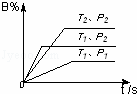
A. T1<T2,P1>P2,m+n>p,Q>0 B. T1>T2,P1<P2,m+n>p,Q<0
C. T1<T2,P1>P2,m+n<p,Q>0 D. T1>T2,P1<P2,m+n<p,Q>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com