
实验室制备氯气的装置如下图。图中涉及气体发生、除杂、干燥、收集、尾气处理装置,其中错误的是 ( )
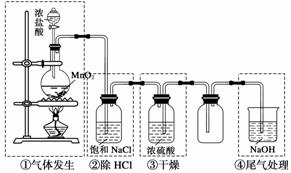
A.① B.② C.③ D.④
科目:高中化学 来源: 题型:
【化学——选修3物质结构与性质】(15分)
A、B、C、D、E、F为周期表中前四周期的六种元素,它们的原子序数依次增大,且均不同族。A、B、C三种元素的基态原子具有相同的能层和能级,且第一电离能I1(A)<I1(C)<I1(B),BC2+与AC2互为等电子体;D、E为同周期相邻元素;F元素位于周期表中1~18列中的第11列。请回答下列问题(答题时请用相应的元素符号表示相应元素):
⑴A元素的价层电子排布图为 ;BC2+的电子式为 ; 基态F原子的核外电子排布简式 。
⑵E元素的电离能情况如图1所示。E元素在周期表中位于 ; D元素单质形成的
晶体晶胞类型属于 堆积。
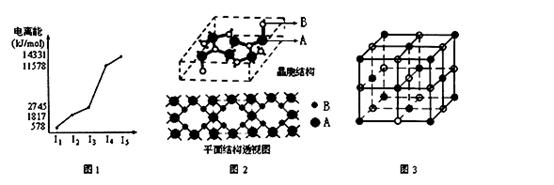
⑶A、B两元素所形成的化合物甲是首屈一指的超硬新材料,其晶胞结构如图2所示,由此可知,化合物
甲的晶体类型为 ,其硬度超过金刚石的原因是 。化合物甲的晶体中B原子的杂化方式为 。
⑷D、C两元素可形成的化合物乙。
①现证实化合物乙的晶体结构如图3所示,晶胞中D离子的配位数为 ;
②设D离子半径分别为a,C离子半径分别为b,则其晶体的空间利用率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组微粒在指定的溶液中一定能大量共存的是( )
A.加入金属镁产生H2的溶液中:NH 、Na+、SO
、Na+、SO 、CH3COO-
、CH3COO-
B.含有大量ClO-的溶液中:K+、Na+、NO 、SO
、SO
C.c(Cu2+)=0.1 mol·L-1的溶液中:H+、NH 、Br-、CO
、Br-、CO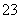
D.含有大量MnO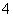 的溶液中:H+、SO
的溶液中:H+、SO 、Cl-、CH3CH2OH
、Cl-、CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
在盛有溴水的三支试管中分别加入少量苯、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是 ( )

A.①加CCl4 ②加苯 ③加酒精
B.①加酒精 ②加CCl4 ③加苯
C.①加苯 ②加CCl4 ③加酒精
D.①加苯 ②加酒精 ③加CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)(3)]光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为_________________________________。
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究卤族元素的有关性质具有重要意义。
(1)下列关于氯水的叙述正确的是________(填写序号)。
a.氯水中存在两种电离平衡
b.向氯水中通入SO2,其漂白性增强
c.向氯水中通入氯气,c(H+)/c(ClO-)减小
d.加水稀释氯水,溶液中的所有离子浓度均减小
e.加水稀释氯水,水的电离平衡向正反应方向移动
f.向氯水中加少量固体NaOH,可能有c(Na+)=c(Cl-)+c(ClO-)
(2)氯气在工业上有着极其广泛的用途。工业上通过氯碱工业生产氯气,其反应的离子方程式为________________________________。室温下,用惰性电极电解100 mL饱和食盐水,当阴极产生标准状况下11.2 mL气体,忽略溶液体积的变化时,所得溶液的pH=____________。
(3)常温下,已知25 ℃时有关弱酸的电离常数:
| 弱酸化学式 | HClO | H2CO3 |
| 电离常数 | K=4.7×10-8 | K1=4.3×10-7, K2=5.6×10-11 |
写出84消毒液(主要成分为NaClO)露置在空气中发生反应的有关化学方程式________________________________________________________________________。
若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会导致中毒,请用离子方程式解释有关原因____________________________________________________________________
________________________________________________________________________。
(4)服用含碘化钾的碘药片可抗核辐射。将碘药片剥去糖衣皮研碎后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水后蓝色溶液又褪为无色。完成并配平溶液由蓝色变为无色的化学反应方程式(如果化学计量数是1,不用填写):_____+______+_______―→_______HIO3+________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某一溴代烷水解后的产物在红热铜丝催化下, 最多可被空气氧化生成4种不同的醛,该一溴代烷的分子式可能是
A.C4H9Br B.C5H11Br C.C6H13Br D.C7H15Br
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com