
| A、样品中含有少量Na2O杂质 |
| B、容量瓶中原来有少量蒸馏水 |
| C、定容时观察液面仰视 |
| D、未冷却至室温直接把NaOH溶液移入容量瓶中 |
| n |
| V |


科目:高中化学 来源: 题型:
| A、漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3- | ||||
| B、稀硫酸和氢氧化钡溶液Ba2++OH-+H++SO42-=BaSO4↓+H2O | ||||
C、向NH4HCO3 溶液中通入少量的NaOH溶液,并加热:NH4++OH-
| ||||
| D、在强碱溶液中,次氯酸钠与Fe(OH)3反应生成Na2FeO4:4OH-+3ClO-+2Fe(OH)3=2FeO42-+3Cl-+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2>I2>S |
| B、H2S>NaI>H2O |
| C、S>I2>O2 |
| D、H2O>NaI>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大于8mL | B、等于8mL |
| C、小于8mL | D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
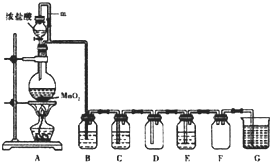 二氧化锰与浓盐酸混合加热得到氯气,如图是制取并探究Cl2化学性质的装置图.
二氧化锰与浓盐酸混合加热得到氯气,如图是制取并探究Cl2化学性质的装置图.查看答案和解析>>
科目:高中化学 来源: 题型:
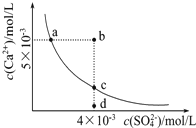
| A、a、c两点均可以表示常温下CaS04溶于水所形成的饱和溶液 |
| B、a点对应的Ksp等于c点对应的Ksp |
| C、向d点溶液中加入适量CaCl2固体可以变到c点 |
| D、b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×l0-3mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com