
| A. | ①⑥ | B. | ①② | C. | ③④⑥ | D. | ⑤⑥ |
分析 ①pH=-lgc(H+),pH相等则氢离子浓度相等;
②碳酸钠溶液显碱性,加水稀释碱性减弱,KW只受温度影响,温度不变其不变;
③醋酸溶液加水稀释,溶液酸性减弱;
④酚酞的变色范围为8-10;
⑤常温下,酸溶液的pH<7;
⑥若1mL pH=1的盐酸与100mL NaOH溶液混合后,溶液的pH=7,说明二者的物质的量相等,则NaOH浓度为0.001mol/L.
解答 解:①pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)=10-pH,两种溶液的pH相等,所以其c(H+)相等,故正确;
②水的离子积常数只与温度有关,温度不变,则Kw不变,故错误;
③加水稀释醋酸促进电离,但稀释过程中醋酸电离增大程度小于溶液体积增大程度,所以稀释后溶液中c(H+)减小,所以a<b,故错误;
④酚酞的变色范围为8-10,所以在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH<8,故错误;
⑤1.0×10-8 mol/L盐酸接近中性,所以该溶液的pH接近7,故错误;
⑥若1mL pH=1的盐酸与100mL NaOH溶液混合后,溶液的pH=7,说明盐酸和NaOH的物质的量相等,则氢氧化钠浓度为盐酸的$\frac{1}{100}$,为0.001mol/L,则NaOH溶液的pH=11,故正确;故选A.
点评 本题考查弱电解质的电离、酸碱混合溶液定性判断、盐类水解等知识点,知道电离平衡常数与盐类水解平衡常数、离子积常数都只与温度有关,与溶液酸碱性及浓度无关,易错选项是⑤,酸或碱溶液接近中性时要考虑水的电离,为易错点.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2悬浊液 | 金属钠 | |
| A | 中和反应 | - | 溶解 | 产生氢气 |
| B | - | 有银镜 | 加热后有砖红色沉淀 | 产生氢气 |
| C | 水解反应 | 有银镜 | 加热后有砖红色沉淀 | - |
| D | 水解反应 | - | - | - |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙:
乙:
| 丙分子式 | C9H8O |
| 部分性质 | 能使Br2/CCl4褪色 |
 $→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙
$→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaCl
+NaCl

 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、MnO4-、Na+、Cl- | B. | Fe3+、Na+、Cl-、SO42- | ||
| C. | NH4+、Na+、NO3-、CO32- | D. | Na+、K+、SiO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
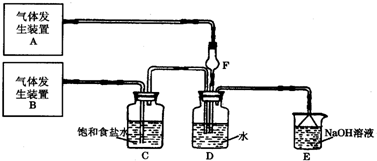
 化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的.结合实验装置图回答问题:
化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的.结合实验装置图回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率增大 | ||
| C. | 物质B的质量分数减小了 | D. | a>b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com