
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 |

| nB |
| V |
| nB |
| V |
| nB |
| V |
| nB |
| V |
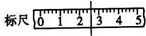 ,
,| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 | ↓↑ | ↓ | ↓↑ | ↓ | ↓↑ |
 ;
;| nB |
| V |


科目:高中化学 来源: 题型:
| A、盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol |
| B、标准状况下,22.4LCCl4的分子数约为NA个 |
| C、17.6g丙烷中所含的极性共价键为4NA个 |
| D、电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH<7的溶液中:Na+、S2-、K+、MnO4- |
| B、pH=7的溶液中:Al3+、Cl-、SO42-、AlO2- |
| C、pH>7的溶液中:Na+、CO32-、SO32-、K+ |
| D、pH=0的溶液中:Na+、Al3+、Fe2+、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,pH=11的Na2CO3溶液中水电离出来的H+数目为10-3 NA |
| B、78 g Na2S和Na2O2的混合物中阴离子的数目为2 NA |
| C、在标准状况下,11.2 L CCl4分子中氯原子数目为2 NA |
| D、室温下,4.4 g乙醛和乙酸乙酯的混合物中含有碳原子数目为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,5.6 L四氯化碳含有的分子数为0.25NA |
| B、标准状况下,14 g氮气含有的核外电子数为5NA |
| C、1mol金属钠与氧气反应,不论生成氧化钠还是过氧化钠,转移电子数都是NA |
| D、标准状况下,铝跟氢氧化钠溶液反应生成1 molH2时,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通入少量氯化氢气体 |
| B、加入少量水 |
| C、加入少量(NH4)2SO4固体 |
| D、加入少量NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com