
分析 (1)根据化学式改写成相应的氧化物得形式,按照活泼金属氧化物•较活泼金属氧化物•SiO2•H2O得顺序来书写,并要遵守原子守恒来分析解答;
(2)①Al2O3是两性氧化物,具有两性氧化物的通性,溶于强酸强碱;②根据一氧化氮、二氧化氮的性质分析;③氯化氢溶于饱和食盐水,而氯气不溶于饱和食盐水;④氯化亚铁能够被氯水氧化成FeCl3;
(3)Na和水反应生成NaOH和H2,NaOH和Al反应生成H2和NaAlO2,其方程式为Na+Al+2H2O=NaAlO2+2H2↑,根据Na和氢气之间的关系式计算.
解答 解:(1)Mg的氧化物为MgO,硅的氧化物为SiO2,氢的氧化物为H2O,则根据活泼金属氧化物•较活泼金属氧化物•SiO2•H2O得顺序可知Mg3Si4O10(OH)2可改成:3MgO•4SiO2•H2O,
故答案为:3MgO•4SiO2•H2O;
(2)①Fe2O3不与氢氧化钠溶液反应,而Al2O3能和氢氧化钠溶液反应化学方程式:Al2O3+2NaOH═2NaAlO2+H2O,则可用氢氧化钠溶液除去Al2O3杂质,
故答案为:NaOH溶液;
②二氧化氮和水反应生成硝酸和一氧化氮H2O+3NO2=2HNO3+NO,一氧化氮和水不反应,所以可用水除去一氧化氮中的二氧化氮,
故答案为:H2O;
③氯化氢能溶于饱和食盐水,而氯气不溶于饱和食盐水,可用饱和食盐水除去氯气中的HCl,
故答案为:饱和食盐水;
④FeCl2与氯水反应生成FeCl3,能除去杂质且没有引入新的杂质,符合除杂原则,反应的离子方程式为2Fe3++Fe═3Fe2+,
故答案为:氯水;
(3)Na和水反应生成NaOH和H2,NaOH和Al反应生成H2和NaAlO2,其方程式为Na+Al+2H2O=NaAlO2+2H2↑,根据方程式知,0.1molNa完全反应生成V(H2)=2n(Na)•Vm=2×0.1mol×22.4L/mol=4.48L>1.12L,
故答案为:b.
点评 本题考查了物质的分离与提纯、混合物反应的计算,题目难度中等,注意掌握物质分离与除杂试剂的选用方法,明确硅酸盐的表示方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LHF中分子总数为NA | |
| B. | 室温下,31.0g白磷中含有的共价键数目为1.5NA | |
| C. | 常温常压下,17 g甲基(-14CH3)所含的电子数为9NA | |
| D. | .将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol/L的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、Cl- | |
| C. | 饱和新制氯水中:Na+、K+、NO3-、I- | |
| D. | 使酚酞试液变红的溶液:Na+、K+、SiO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.25mol/L | B. | 2mol/L | C. | 4mol/L | D. | 0.6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.7g羟基(-OH)中含有的电子数为NA | |
| B. | 6.4g由S2、S4、S8组成的混 合物含硫原子数为0.2NA | |
| C. | 标准状况下2.24L己烷分子中含有1.9NA对共用电子 | |
| D. | 标准状况下,2.24LCl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
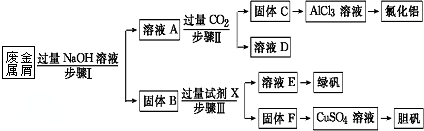
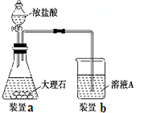 一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少.为了避免固体C减少,可采取的改进措施是在装置I和Ⅱ之间增加一个盛有饱和NaHCO3溶液的洗气瓶
一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少.为了避免固体C减少,可采取的改进措施是在装置I和Ⅱ之间增加一个盛有饱和NaHCO3溶液的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液:HCO3-+H2O?CO32-+H3O+ | |
| B. | NaHS溶液:HS-+H2O?H2S+OH- | |
| C. | Na2CO3溶液:CO32-+2H2O?H2CO3+2OH- | |
| D. | NH4Cl溶于D2O中:NH4++D2O?NH3•D2O+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com