
| A��pH��ͬ�Ģ�CH3COONa����NaHCO3����Na2CO3������Һ�е�c��Na+�����ۣ��ڣ��� |
| B��0.1mol?L-1ij��Ԫ����ǿ����NaHA��Һ�У�c��Na+��=2c��A2-��+c��HA-��+c��H2A�� |
C����ͼ��pH=7ʱ��c��Na+����c��CH3COO-����c��OH-��=c��H+��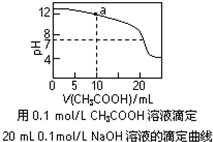 |
D����ͼ��a����Һ�и�����Ũ�ȵĹ�ϵ�ǣ�c��OH-��=c��H+��+c��CH3COO-��+2c��CH3COOH�� |


 ��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д� �����������Ż�ѧϰϵ�д�
�����������Ż�ѧϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
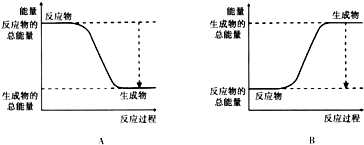
| ��ѧ�� | H-H | O=O | H-O |
| ���� | 436 | 496 | 463 |
| ��ѧ�� | ����������� �ų������� |
�����仯 | |
| ��ѧ�� | 2molH2�еĻ�ѧ�� | ||
| 1molO2�еĻ�ѧ�� | |||
| �γɻ�ѧ�� | 4molH-O�� | ||
| �������仯 | |||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����³�ѹ�µ�33.6L������27g����ַ�Ӧ��ת�Ƶĵ�����ΪNA |
| B����״���£�2.24Lˮ��Լ����6.02��1023����ԭ�� |
| C����CO2��O2��ɵĻ�����й���NA�����ӣ����е���ԭ����Ϊ2NA |
| D��1L 1mol/LHCl��Һ�к���HCl����ΪNA�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�� ����K+�Ĵ��� |
B�� ���� |
C�� ����ƾ���ˮ |
D�� ����ʳ��ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ۢߢݢܢޢ٢ڢ� |
| B���ޢۢߢݢܢ٢� |
| C���ޢߢݢۢܢ٢� |
| D���ޢߢۢݢܢڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Na+ Ag+ OH- Cl- |
| B��Na+ Mg2+ SO42- NO3- |
| C��K+ NH4+ CO32- OH- |
| D��H+Fe2+ ClO- NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
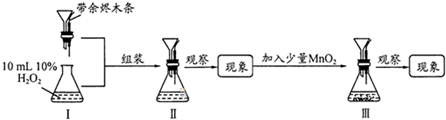
| A��ʵ��ʱ�ȼ�H2O2���MnO2�����������Һ���� |
| B��Ϊʹʵ��˳�����У�H2O2���˴�ͼ��©�������� |
| C�����ɹ۲쵽Ѹ�ٲ����������ݣ������ȼ |
| D�����������в����ȼ���MnO2�ٲ���������ľ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ij��ɫ����������Һ��Cl-��Na+��MnO4-��SO42- |
| B����ʹpH��ֽ������ɫ����Һ��Na+��NH4+��K+��CO32- |
| C���������NaOH��Һ��ɵõ��������Һ��K+��Ba2+��HCO3-��Cl- |
| D����ˮ���������c��H+��=10-12mol/L����Һ��K+��Ba2+��Cl-��NO3- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com