
关于常温下pH=3的醋酸溶液,下列叙述正确的是
A.加水稀释10倍后,pH=4 B.加水稀释后,溶液中c(H+)和c(OH-)均减少
C.加入醋酸钠晶体后,溶液的pH增大 D.加入等体积pH=11的NaOH溶液后,溶液呈中性
科目:高中化学 来源:2014秋江苏省东台市高二第一学期期中考试化学试卷(解析版) 题型:选择题
在一定条件下,下列物质不能发生消去反应的是
A.C2H5OH B.(CH3)2CHCl C.(CH3)3CCl D.(CH3)3CCH2Cl
查看答案和解析>>
科目:高中化学 来源:2014秋广东省揭阳市高二第一学期期中考试化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是
A.钠投入水中:Na+H2O=Na++OH-+H2↑
B.碳酸钙与醋酸反应:CO32-+2CH3COOH===CO2↑+H2O+2CH3COO-
C.少量碳酸氢钙溶液与足量氢氧化钠溶液反应:Ca2+ + HCO3- + OH-= CaCO3 ↓ + H2O
D.铜片插入硝酸银溶液中:Cu + 2Ag+ = Cu2+ + 2Ag
查看答案和解析>>
科目:高中化学 来源:2014秋广东省高二上学期期中考试(理)化学试卷(解析版) 题型:填空题
(8分)
I. 已知在25℃时,HF、HCN和H2CO3的的电离平衡常数如表所示:
(1)写出碳酸的第一级电离平衡常数表达式:K1= 。
(2)①往Na2CO3溶液中加入足量HF溶液,发生反应的离子方程式:
②往NaCN溶液中通入少量CO2,发生反应的离子方程式:
II. 用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2014秋广东省高二上学期期中考试(理)化学试卷(解析版) 题型:选择题
下列实验不能达到预期目的的是:
序号 | 实验操作 | 实验目的 |
A | 配制FeCl2溶液时,向溶液中加入少量Fe和稀盐酸 | 抑制Fe2+水解和防止Fe2+被氧化 |
B | 将饱和FeCl3溶液滴入沸水中,溶液变红褐色 | 制备Fe(OH)3胶体 |
C | 测定等浓度的Na2CO3和Na2SO3 溶液的pH,前者pH比后者的大 | 比较S、C的非金属性强弱 |
D | 将充满NO2的密闭玻璃球浸泡在热水中 | 研究温度对化学平衡移动的影响 |
查看答案和解析>>
科目:高中化学 来源:2014秋广东省高二上学期期中考试(理)化学试卷(解析版) 题型:选择题
下列实验操作正确的是
A. 用右图装置测定中和热 
B.中和滴定过程中,眼睛应注视锥形瓶内溶液颜色的变化
C.研究H+浓度对该平衡:Cr2O72- + H2O 2CrO42- +2H+的影响,往5mL 0.1mol/L K2CrO4溶液加入5mL 0.1mol/L的稀硫酸
2CrO42- +2H+的影响,往5mL 0.1mol/L K2CrO4溶液加入5mL 0.1mol/L的稀硫酸
D.测定溶液的pH值时,用玻璃棒蘸取少量溶液点在湿润的pH试纸上再与标准比色卡对照
查看答案和解析>>
科目:高中化学 来源:2014秋广东省高二上学期期中考试(文)化学试卷(解析版) 题型:选择题
可用于鉴别乙酸和乙醇的是
A.NaCl溶液 B.KNO3溶液
C.Na2CO3溶液 D.紫色石蕊试液
查看答案和解析>>
科目:高中化学 来源:2014秋广东省高二上学期期中考试(文)化学试卷(解析版) 题型:选择题
某温度下,化学反应 A = B + C中反应物A的浓度在5s内从2.0 mol/L减少到1.0 mol/L。在这段时间内,用A的浓度变化表示的平均反应速率为
A.0.4 mol?L—1 B.0.2 mol?L—1
C.0.4 mol?L—1?s—1 D.0.2 mol?L—1?s—1
查看答案和解析>>
科目:高中化学 来源:2014秋广东省广州市高二上学期期中考试化学(理)试卷(解析版) 题型:填空题
(14分)
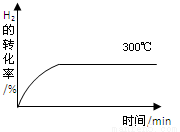
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)  CH3OH(g) 下表为不同温度下的平衡常数(K)
CH3OH(g) 下表为不同温度下的平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
(1)该反应的平衡常数表达式K= ,ΔH 0(填“>”、“<”或“=”)。
(2)将1 mol的H2 和 1 mol 的 CO充入 1 L 恒容密闭反应器中,达到平衡后,容器内的压强为开始时的60%,求CO的平衡转化率(写出计算过程)。
(3)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是
(填字母)。
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡时c(H2)/ c(CH3OH)减小
(4)其他条件相同时,在上述三个温度下分别发生该反应。300℃时,H2的转化率随时间的变化如图所示,请补充完成350℃时H2的转化率随时间的变化示意图。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com