
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
分析 ①中为了不引入其他杂质离子,应加氨水使Fe3+沉淀,而不能用氢氧化钠溶液;
②中根据溶解度表可知Mg(OH)2易转化为Fe(OH)3,因此在氯化镁溶液中加入足量的Mg(OH)2可除去Fe3+;
③由于Fe(OH)2的溶解度大于Fe(OH)3,所以一般将Fe2+先氧化成Fe3+,再调节溶液的pH=4,形成Fe(OH)3沉淀;
(1)Fe(OH)2的溶解度大于Fe(OH)3,上述三个除杂方案都能够达到很好的效果,Fe2+、Fe3+都被转化为Fe(OH)3而除去;
(2)除去铁离子,可加入氨水,防止引入其它杂质;
(3)除去氯化镁晶体中的杂质Fe3+,加入氢氧化镁,可消耗酸,调节溶液pH,促进水解;
(4)A.根据H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染;
B.根据Fe(OH)2的溶解度大于Fe(OH)3,形成Fe(OH)2沉淀Fe2+沉淀不完全;
C.原来溶液是酸性较强,加入氢氧化铜或碱式碳酸铜可以与H+反应.H+反应后,PH增大,当PH=4的时候,Fe(OH)3完全沉淀,而Cu2+还没沉淀,加入氢氧化铜或碱式碳酸铜是固体,不会引入新的杂质;
D.根据溶度积计算;
E.在pH>4的溶液中Fe3+全部以Fe(OH)3完全沉淀.
解答 解:①中为了不引入其他杂质离子,应加氨水使Fe3+沉淀,而不能用氢氧化钠溶液;
②中根据溶解度表可知Mg(OH)2易转化为Fe(OH)3,因此在氯化镁溶液中加入足量的Mg(OH)2可除去Fe3+;
③由于Fe(OH)2的溶解度大于Fe(OH)3,所以一般将Fe2+先氧化成Fe3+,再调节溶液的pH=4,形成Fe(OH)3沉淀;
(1)由以上分析可知Fe3+、Fe2+ 都被转化为Fe(OH)3沉淀,故答案为:Fe(OH)3;
(2)①中为了不引入其他杂质离子,应加氨水使Fe3+沉淀,而不能用氢氧化钠溶液,故答案为:氨水;不会引入新的杂质;
(3)②中根据溶解度表可知Mg(OH)2易转化为Fe(OH)3,发生Fe3+:2Fe3+(aq)+3Mg(OH)2(s)═3Mg2+(aq)+2Fe(OH)3(s),
故答案为:2Fe3+(aq)+3Mg(OH)2(s)═3Mg2+(aq)+2Fe(OH)3(s);
(4)A.H2O2是绿色氧化剂,还原产物为水,在氧化过程中不引进杂质、不产生污染,故A正确;
B.Fe(OH)2的溶解度大于Fe(OH)3,将Fe2+氧化为Fe3+的主要原因是防止沉淀不完全,故B错误;
C.原来溶液是酸性较强,加入氢氧化铜或碱式碳酸铜可以与H+反应.H+反应后,PH增大,当PH=4的时候,Fe(OH)3完全沉淀,而Cu2+还没沉淀.而氢氧化铜或碱式碳酸铜是固体,不会引入新的杂质,故C正确;
D.由表中数据可知Cu(OH)2的溶解度为1.7×10-6g,则饱和溶液的c(OH-)=2c(Cu(OH)2)=$\frac{\frac{1.7×1{0}^{-6}g}{98g/mol}}{0.1L}×2$≈3.4×10-7mol/L>1×10-10mol/L,所以Cu2+可以大量存在于pH=4的溶液中,故D正确;
E.由表中数据可知Fe(OH)3的溶解度为3×10-9g,则饱和溶液的c(OH-)=3c(Fe(OH)3)=$\frac{\frac{3×1{0}^{-9}}{107g/mol}}{0.1L}×3$=3.0×10-10mol/L,则在pH>4的溶液中Fe3+全部以Fe(OH)3完全沉淀,Fe3+一定不能大量存在,故E正确;
故选:ACDE.
点评 本题以难溶电解质的溶解平衡为载体综合考查物质的分离、提纯,为高频考点,侧重学生的分析、实验能力的考查,注意把握盐类水解的原理以及溶解平衡的理解和运用,难度中等.


科目:高中化学 来源: 题型:解答题
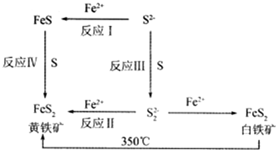 Ⅰ.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-═Li2S+Fe,则该电池的总反应式为2Li+FeS═Li2S+Fe.
Ⅰ.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-═Li2S+Fe,则该电池的总反应式为2Li+FeS═Li2S+Fe.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输 | |
| B. | 氢氧化镁分解时吸收大量热量,可添加到合成树脂中做阻燃剂 | |
| C. | 酒精能使蛋白质变性,无水酒精在医学上常被用于消毒 | |
| D. | 利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
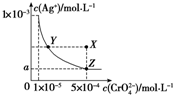
| A. | T℃时,在Y点和Z点,Ag2CrO4的Ksp相等 | |
| B. | 向饱和AgCrO4溶液中加入固体K2CrO4不能使溶液由Y点变为X点 | |
| C. | T℃时,Ag2CrO4的Ksp为1×10-8 | |
| D. | 图中a=$\sqrt{2}$×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl分子中的共价键是由H原子的1s轨道和Cl原子未成对电子的3p轨道形成的s-pσ键 | |
| B. | 石墨晶体中碳原子的杂化轨道类型为sp2,碳原子间只存在sp2-sp2σ键 | |
| C. | H2O分子中的共价键是由O原子的sp3杂化轨道和H原子的s轨道形成的s-sp3σ键 | |
| D. | N2分子中的共价键是由2个N原子各自用3个p轨道形成的3个p-pπ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | NaCl和NaBr | C. | NaBr | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com