
| A. | ①②④ | B. | ②④ | C. | ①②③ | D. | 只有② |
分析 一般来说,升高温度、增大浓度、加入催化剂以及增大反应气体的压强,可增大反应速率,注意增大压强时,反应物的浓度增大,反应速率才能增大,以此解答.
解答 解:①如果为固体,增大反应物的量,浓度不变,反应速率不变,故错误;
②升高温度,活化分子的百分数增大,反应速率增大,故正确;
③缩小容器的体积,对于非气体的反应,是不会改变反应速率的,如在反应体系中加入惰性气体,虽然压强增大,但参加反应的气体的浓度不变,则反应速率不变,故错误;
④加入生成物,如果为固体,增大生成物的量,浓度不变,反应速率不变,故错误;
故选D.
点评 本题考查反应速率的影响因素,为高频考点,侧重于学生的分析能力和基本理论知识的理解和运用的考查,注意相关基础知识的积累,把握影响反应速率的因素和影响原因,难度不大.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一主族的元素称为碱金属 | |
| B. | 第二周期元素的最高化合价依次递增,并等于它所处的主族序数 | |
| C. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| D. | 同一主族的元素的原子,最外层电子数一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
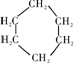 .若该有机物M能使溴水褪色,且所有碳原子共面,则M的结构简式为(CH3)2C=C(CH3)2.
.若该有机物M能使溴水褪色,且所有碳原子共面,则M的结构简式为(CH3)2C=C(CH3)2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 2 | ① | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | |||||
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
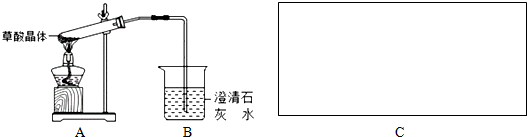

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知NaHA溶液呈碱性,则该溶液中:c(A2-)>c(H2A) | |
| B. | 在小苏打溶液中存在下列关系:c(HCO3-)+c (CO32-)=c(Na+) | |
| C. | 常温下,稀释0.1 mol/L的氨水,水的电离程度减小 | |
| D. | 向AgCl悬浊液中加入足量的NaI,会观察到有黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
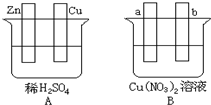 按要求对图中两极进行必要的联接并填空:
按要求对图中两极进行必要的联接并填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ②⑤ | D. | ④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com