
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少许反应后溶液于试管中,滴加 | 若 ,则假设 成立。 |
| 步骤:2:另取少许反应后溶液于试管中,滴加 | 若 ,则假设 成立。 若 , 则假设3成立。 |
| 实验步骤 | 预期现象和结论 |
| 步骤1: 1 mol/L的CuSO4溶液 | 溶液中出现黑色沉淀 , 则假设 1 成立。 |
| 步骤:2: 1-2滴淀粉KI溶液 | 若 溶液变蓝 , 则假设 2 成立。 若 步骤1中没有出现黑色沉淀,步骤2中溶液不变蓝色 , 则假设3成立。 |


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源:不详 题型:填空题

 CuY2–+ 2H+。则CuSO4·5H2O质量分数的表达式是 。
CuY2–+ 2H+。则CuSO4·5H2O质量分数的表达式是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
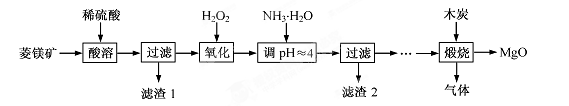
 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑ MgO+SO2↑+CO↑
MgO+SO2↑+CO↑ MgO+S↑+3CO↑
MgO+S↑+3CO↑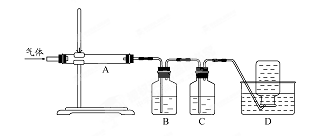
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 乙烯的制备 | 试剂X | 试剂Y |
| A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
| C | C2H5OH与浓H2SO4加热至170 ℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | C2H5OH与浓H2SO4加热至170 ℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
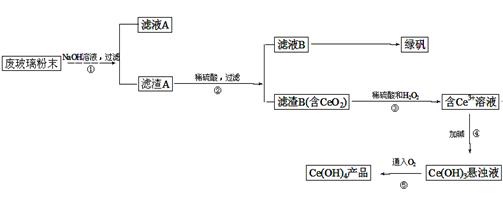
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

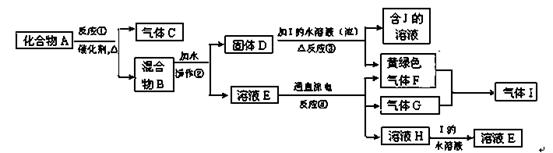
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
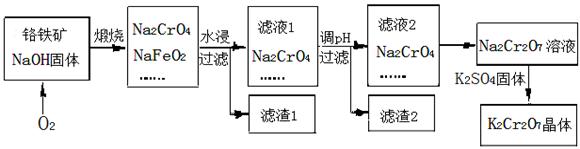
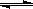 2CrO42- + 2H+
2CrO42- + 2H+| A.蒸馏水 | B.酒精 | C.稀硫酸 | D.饱和K2SO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com