

分析 (1)根据蔗糖在浓硫酸中脱水过程中放出大量的热进行分析;
(2)铝和四氧化三铁在高温下发生氧化还原反应生成铁和氧化铝,据此写出反应的化学方程式;
(3)①由于温度、压强影响气体体积,所以应该先冷却到室温,然后调节量气管使左右液面相平,最后读数时视线与凹液面最低处相平;
②量气管的量具部分底部是连接橡胶管,结合实验量具可知是碱式滴定管的部分结构;
③根据生成氢气的量及反应关系式列式计算出样品中铝的质量分数;
④如果装置没有橡胶管,随液体流下试管中压强增大,在排液过程中会排出的液体增多,导致测定结果偏高.
解答 解:(1)由于蔗糖在浓硫酸中脱水并放出大量的热,所有实验中可以用蔗糖和浓硫酸代替镁条引火剂,
故答案为:蔗糖在浓硫酸中脱水并放出大量的热;
(2)在高温条件下,铝和四氧化三铁发生氧化还原反应生成铁和氧化铝,反应的化学方程式为:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe,
故答案为:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe;
(3)①量气管的量具部分底部是连接橡胶管,结合实验量具可知是碱式滴定管的部分结构,所以该仪器的名称为碱式滴定管,
故答案为:碱式滴定管;
②对量气管读书时,首先等实验装置恢复到室温再进行下一步操作,然后调节量气管使左右液面相平,最后读数时视线与凹液面最低处相平,保证在常温常压下进行,
故答案为:冷却至室温和调节量气管使左右液面相平;
③标准状况下44.8mL氢气的物质的量为:$\frac{0.0448L}{22.4L/mol}$=2×10-3mol,根据关系式2Al~3H2可知,生成标准状况下44.8mL氢气消耗铝的质量为:27g/mol×2×10-3mol×$\frac{2}{3}$=0.036g,则铝的百分含量为:$\frac{0.036g}{1g}$×100%=3.6%,
故答案为:3.6%;
④橡胶管可以平衡压强让液体顺利滴入试管中,还可以起到降低实验误差的作用,如果装置中没有橡胶管,随液体流下试管中压强增大,试管中排出液体增多,测量出的该物质百分含量将会偏大,
故答案为:偏大.
点评 本题考查了铝热反应原理及其综合应用,题目难度中等,涉及铝热反应方程式的书写、化学计算、误差分析等知识,注意掌握铝热反应原理,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验能力.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:解答题
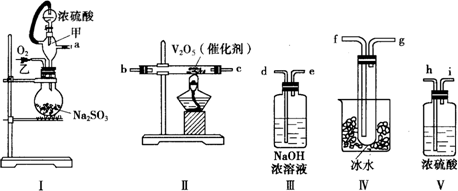
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
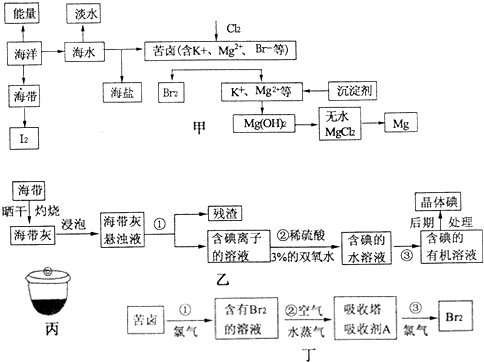
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓盐酸 | B. | 氯化钠晶体 | C. | 浓氨水 | D. | 氢氧化钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | y>2x+2 | B. | 2x≥y-2 | C. | x﹕y﹕z=1﹕2﹕1 | D. | y=2z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. .
.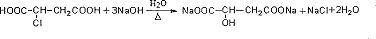 .
. 等.
等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com