
有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Fe2+、Ba2+、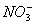 、SO
、SO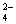 、
、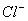 、
、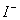 、
、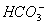 ,取该溶液实验如下:
,取该溶液实验如下:
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| ②取少量该溶液,浓缩,加Cu片和浓H2SO4,加热 | 有无色气体产生,后在空气中又变成红棕色 |
| ③取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| ④取③中上层清液,加AgNO3溶液 | 有白色沉淀生成,且不溶于HNO3 |
| ⑤取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
(1)溶液中肯定存在的离子是________________________。
(2)溶液中肯定不存在的离子是________________________。
(3)为进一步确定其他离子,应该补充的实验是________ _ ________
。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列溶液中氯离子浓度与50mL 1 mol·L-1 AlCl3溶液中氯离子浓度相等的是 ( )
A.150ml 1mol·L-1 NaCl溶液 B.75ml 2mol·L-1 KClO3溶液
C.150ml 2mol·L-1 KCl溶液 D.75ml 1mol·L-1 FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.KClO3 和SO3 溶于水后能导电,故KClO3 和SO3 为电解质
B.25℃时、用醋酸溶液滴定等浓度NaOH 溶液至pH=7,V 醋酸<V NaOH
C.向NaAlO2 溶液中滴加NaHCO3 溶液,有沉淀和气体生成
D.AgCl 易转化为AgI 沉淀且K(AgX)=c(Ag+ )·c(X—),故K(AgI)<K(AgCl)
查看答案和解析>>
科目:高中化学 来源: 题型:
用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中
C(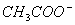 )>C(Na+),对该混合溶液的下列判断正确的是 ( )
)>C(Na+),对该混合溶液的下列判断正确的是 ( )
A.C(H+)>C(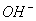 )
)
B.C(CH3COOH)+C(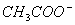 )=0.2 mol/L
)=0.2 mol/L
C.C(CH3COOH)>C(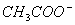 )
)
D.C(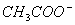 )+C(OH-)=0.2 mol/L
)+C(OH-)=0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在溶液中不能大量共存,且加入过量NaOH溶液或过量稀盐酸均能得到澄清溶液的是 ( )
A. Fe3+、CI-、Na+、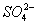 B. Al3+、Na+、
B. Al3+、Na+、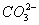 、
、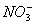
C. Ag+、Na+、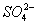 、
、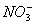 D. AlO2-、
D. AlO2-、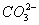 、K+、Na+
、K+、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
某厂废水中含5.00×2013-3mol·L-1的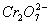 ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料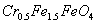 (
(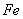 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:
(1)第①步反应的离子方程式是
(2)第②步中用PH试纸测定溶液PH的操作是:
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有
(4)欲使1L该废水中的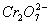 完全转化为
完全转化为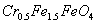 。理论上需要加入
。理论上需要加入
GFeSO4·7H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下是25℃时几种难溶电解质的溶解度:
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×12-4 | 1.7×12-6 | 1.5×12-4 | 3.0×12-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,加入一定量的试剂反应,过滤结晶
② 为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶
③ 为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为 而除去
(2)①中加入的试剂应该选择_________为宜,其原因是________________________。
(3)②中除去Fe3+所发生的总反应的离子方程式为_____________________________。
(4)下列与方案③相关的叙述中,正确的是__________________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应反应N2(g)+3H2(g)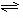 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);,使用催化剂 反应的ΔH(填“增大”“减小”或“不改变”)
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);,使用催化剂 反应的ΔH(填“增大”“减小”或“不改变”)
(2)O2 (g)= O+2(g)+e-  H1= 1175.7 kJ·mol-1
H1= 1175.7 kJ·mol-1
PtF6(g)+ e-1 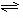 PtF6-(g)
PtF6-(g)  H2= - 771.1 kJ·mol-1
H2= - 771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6-  H3=482.2 kJ·mol-1
H3=482.2 kJ·mol-1
则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的 H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×12-11,KsP[Cu(OH)2]=2.2×12-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c( ),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________
),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,对于反应2A(g)+B(g)  2C(g),下列说法中正确的是
2C(g),下列说法中正确的是
A.此反应的平衡常数K= 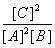
B.改变条件该反应的平衡常数K一定不变
C.改变压强并加入催化剂,平衡常数会随之变化
D.平衡时增大A和B的浓度,平衡常数会减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com