
”¾ĢāÄæ”放ø£½ØŹ”ĮśŃŅŹŠ2017½ģøßČż5ŌĀ×ŪŗĻÄÜĮ¦²āŹŌ£Ø¶ž£©”æ2017ÄźĪŅ¹ś×ŌÖ÷²śČØ”°Č«ĒņŹ×Ģ×Ćŗ»łŅŅ“¼¹¤Ņµ»ÆĻīÄæ”±Ķ¶²ś³É¹¦”£”°Ćŗ»łŅŅ“¼”±¾ĶŹĒŅŌĆŗĪŖŌĮĻÖʱøŅŅ“¼”£ŅŅ“¼ÄÜ×öČ¼ĮĻ£¬æÉŅŌĢķ¼Óµ½ĘūÓĶÖŠ”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
A. ĆŗÖĘŅŅ“¼£¬ÓŠĄūÓŚ±£»¤»·¾³£¬ŹµĻÖÄÜŌ“³ä·ÖĄūÓĆ
B. ĆŗÖĘŅŅ“¼æÉ»ŗ½āææ·¢½Ķ²śÉśŅŅ“¼µ¼ÖĀµÄ”°ÓėČĖĄąÕłĮø”±µÄ¾ÖĆę
C. µČĪļÖŹµÄĮæµÄŅŅ“¼”¢ĘūÓĶĶźČ«Č¼ÉÕ£¬ŅŅ“¼·Å³öµÄČČĮæ¶ą
D. ŅŅ“¼ŹĒŹĄ½ē¹«ČĻµÄÓÅĮ¼ĘūÓĶĢķ¼Ó¼Į£¬æÉÓŠŠ§øÄÉĘĘūÓĶĘ·ÖŹ
 ¼ā×ÓÉśŠĀæĪĢĆæĪŹ±×÷ŅµĻµĮŠ“š°ø
¼ā×ÓÉśŠĀæĪĢĆæĪŹ±×÷ŅµĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄÜÖ¤Ć÷ŅŅĖįŹĒČõĖįµÄŹµŃéŹĀŹµŹĒ
A£®CH3COOHČÜŅŗÓėZn·“Ó¦·Å³öH2
B£®0.1mol/L CH3COONaČÜŅŗµÄpH“óÓŚ7
C£®CH3COOHČÜŅŗÓėNaCO3·“Ӧɜ³ÉCO2
D£®0.1 mol/L CH3COOHČÜŅŗæÉŹ¹×ĻÉ«ŹÆČļ±äŗģ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĮņµÄ»ÆŗĻĪļŌŚÉś²śÉś»īÖŠÓŠ¹ć·ŗÓ¦ÓĆ”£
£Ø1£©Įņ»ÆÄĘÖ÷ŅŖÓĆӌʤøļ”¢Ć«·Ä”¢øßµµÖ½ÕÅ”¢Č¾ĮĻµČŠŠŅµ”£Éś²śĮņ»ÆÄĘ“ó¶ą²ÉÓĆĪŽĖ®Ć¢Ļõ£ØNa2SO4£©-Ģæ·Ū»¹Ō·Ø£¬ĘäĮ÷³ĢŹ¾ŅāĶ¼ČēĻĀ£ŗ

¢Ł ÉĻŹöĮ÷³ĢÖŠ²ÉÓĆĻ”¼īŅŗ±ČÓĆČČĖ®øüŗĆ£¬ĄķÓÉŹĒ__________________”£
¢Ś Č”Įņ»ÆÄĘ¾§Ģå£Øŗ¬ÉŁĮæNaOH£©¼ÓČėµ½ĮņĖįĶČÜŅŗÖŠ£¬³ä·Ö½Į°č”£Čō·“Ó¦ŗó²āµĆČÜŅŗµÄpH£½4£¬Ōņ“ĖŹ±ČÜŅŗÖŠc( S2-)£½______mol”¤L-1”££ØŅŃÖŖ£ŗ³£ĪĀŹ±CuS”¢Cu(OH)2µÄKsp·Ö±šĪŖ8.8”Į10-36”¢2.2”Į10-20£©
£Ø2£©¹¤ŅµÉĻ³£ĄūÓĆ·Ļ¼īŌü£ØÖ÷ŅŖ³É·ÖNa2CO3£©ĪüŹÕĮņĖį³§Ī²ĘųÖŠµÄSO2ÖʱøĪŽĖ®Na2SO3”£KIO3µĪ¶Ø·Øæɲā¶Ø³ÉĘ·ÖŠNa2SO3µÄŗ¬Įæ£ŗŹŅĪĀĻĀ½«0.1260g ³ÉĘ·ČÜÓŚĖ®²¢¼ÓČėµķ·Ū×öÖøŹ¾¼Į£¬ŌŁÓĆ0.01000 mol”¤L1 KIO3ĖįŠŌ±ź×¼ČÜŅŗµĪ¶ØÖĮÖÕµć£¬ĻūŗÄKIO3ČÜŅŗ31.25mL”£
¢Ł µĪ¶ØÖÕµć¹Ū²ģµ½µÄĻÖĻóĪŖ£ŗ_____________________”£
¢Ś ³ÉĘ·ÖŠNa2SO3µÄÖŹĮæ·ÖŹżŹĒ_________£ØĒėŠ“³ö¼ĘĖć¹ż³Ģ£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻÖÓŠČż×éČÜŅŗ£ŗ¢ŁĘūÓĶŗĶĀČ»ÆÄĘČÜŅŗ ¢Ś39%µÄŅŅ“¼ČÜŅŗ ¢ŪĀČ»ÆÄĘŗĶµ„ÖŹäåµÄĖ®ČÜŅŗ£¬·ÖĄėŅŌÉĻø÷»ģŗĻŅŗµÄÕżČ··½·ØŅĄ“ĪŹĒ£Ø £©
A.·ÖŅŗ”¢ÕōĮó”¢ŻĶČ”
B.ŻĶČ””¢ÕōĮ󔢷ÖŅŗ
C.·ÖŅŗ”¢ŻĶČ””¢ÕōĮó
D.ÕōĮó”¢ŻĶČ””¢·ÖŅŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬Ļņ10mL0.1mol”¤L£1H2AČÜŅŗÖŠÖšµĪ¼ÓČė0.1mol”¤L£1NaOHČÜŅŗ”£ÓŠ¹ŲĪ¢Į£µÄĪļÖŹµÄĮæ±ä»ÆČēĶ¼£ØĘäÖŠ¢ń“ś±ķH2A£¬¢ņ“ś±ķHA-£¬¢ó“ś±ķA2-£©”£øł¾ŻĶ¼Ź¾·ÖĪöÅŠ¶Ļ£¬ĻĀĮŠĪ¢Į£ÅØ¶Č“óŠ”¹ŲĻµÕżČ·µÄŹĒ

A. µ±v=0Ź±£¬c(H+)=c(OH-)+c(HA-)+c(A2-)
B. µ±v=10Ź±£¬c(Na+)=c(H2A)+c(HA-)+c(A2-)
C. µ±v=20Ź±£¬c(Na+)£¾c(A2-)£¾c(HA-)£¾c(OH-)£¾c(H+)
D. µ±pH=7Ź±£¬c(Na+)£¾c(HA-)+ c(A2-)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĖę×ÅæĘ¼¼µÄ½ų²½£¬ŗĻĄķĄūÓĆ׏Ō“”¢±£»¤»·¾³³ÉĪŖµ±½ńÉē»į¹Ų×¢µÄ½¹µć
£Ø1£©°±µŖŹĒŌģ³ÉĖ®Ģåø»ÓŖŃų»ÆµÄÖŲŅŖŅņĖŲÖ®Ņ»£¬ÓĆ“ĪĀČĖįÄĘĖ®½āÉś³ÉµÄ“ĪĀČĖį½«Ė®ÖŠµÄ°±µŖ£ØÓĆNH3±ķŹ¾£©×Ŗ»ÆĪŖµŖĘų³żČ„£¬ĘäĻą¹Ų·“Ó¦µÄÖ÷ŅŖČČ»Æѧ·½³ĢŹ½ČēĻĀ£ŗ
·“Ó¦¢Ł£ŗNH3£Øaq£©+HClO£Øaq£©= NH2Cl£Øaq£©+H2O£Øl£©”÷H1= akJmol©1
·“Ó¦¢Ś£ŗNH2Cl£Øaq£©+HClO£Øaq£©= NHCl2£Øaq£©+H2O£ØI£©”÷H2= bkJmol©1
·“Ó¦¢Ū£ŗ2NHCl2£Øaq£©+H2O£Øl£©= N2£Øg£©+HClO£Øaq£©+3HCl£Øaq£©”÷H3= ckJmol©1
¢Ł 2NH3£Øaq£©+3HClO£Øaq£©= N2£Øg£©+3H2O£ØI£©+3HCl£Øaq£©µÄ”÷H=______”£
¢Ś ČÜŅŗpH¶Ō“ĪĀČĖįÄĘČ„³ż°±µŖÓŠ½Ļ“óµÄÓ°Ļģ£ØČēĶ¼1ĖłŹ¾£©”£ŌŚpH½ĻµĶŹ±ČÜŅŗÖŠÓŠĪŽÉ«ĪŽĪ¶µÄĘųĢåÉś³É£¬°±µŖČ„³żŠ§ĀŹ½ĻµĶ£¬ĘäŌŅņŹĒ_________________”£
¢Ū ÓƵē»Æѧ·ØŅ²æÉŅŌČ„³ż·ĻĖ®ÖŠ°±µŖ£®ŌŚÕōĮóĖ®ÖŠ¼ÓČėĮņĖįļ§ÓƶčŠŌµē¼«Ö±½Óµē½ā·¢ĻÖ°±µŖČ„³żŠ§ĀŹ¼«µĶ£¬µ«ŌŚČÜŅŗÖŠŌŁ¼ÓČėŅ»¶ØĮæµÄĀČ»ÆÄĘŗó£¬Č„³żŠ§ĀŹæÉŅŌ“ó“óĢįøß”£·“ӦװÖĆČēĶ¼2ĖłŹ¾£¬bĪŖµē¼«__¼«£¬µē½āŹ±Ņõ¼«µÄµē¼«·“Ó¦Ź½ĪŖ_____________”£

£Ø2£©”°µĶĢ¼¾¼Ć”±Õż³ÉĪŖæĘѧ¼ŅŃŠ¾æµÄÖ÷ŅŖæĪĢā”£
¢Ł ŅŌ¶žŃõ»ÆīѱķĆęø²øĒCu2Al2O4 ĪŖ“߻ƼĮ£¬æÉŅŌ½«CO2 ŗĶCH4 Ö±½Ó×Ŗ»Æ³ÉŅŅĖį”£ŌŚ²»Ķ¬ĪĀ¶ČĻĀ“߻ƼĮµÄ“߻Ɗ§ĀŹÓėŅŅĖįµÄÉś³ÉĖŁĀŹČēÓŅĶ¼ĖłŹ¾”£250”«300 ”ꏱ£¬ĪĀ¶ČÉżø߶ųŅŅĖįµÄÉś³ÉĖŁĀŹ½µµĶµÄŌŅņŹĒ__________________”£
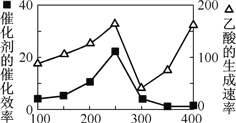
¢Ś ĪŖĮĖĢįøßøĆ·“Ó¦ÖŠCO2µÄ×Ŗ»ÆĀŹ£¬æÉŅŌ²ÉČ”µÄ“ėŹ©ŹĒ_____________”££ØŠ“Ņ»Ģõ¼“æÉ£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹŖ·ØĮ¶Šæ²śÉśµÄĶļÓŌüÖ÷ŅŖŗ¬Šæ”¢Ķ”¢Ģś”¢ļÓ£ØCd£©”¢īÜ£ØCo£©µČµ„ÖŹ”£Ņ»ÖÖÓÉĶļÓŌüÉś²ś½šŹōļÓµÄĮ÷³ĢČēĻĀ£ŗ

ĻĀ±ķĮŠ³öĮĖĻą¹Ų½šŹōĄė×ÓÉś³ÉĒāŃõ»ÆĪļ³ĮµķµÄpH£ØæŖŹ¼³ĮµķµÄpH°“½šŹōĄė×ÓÅضČĪŖ0.1mol/L¼ĘĖć£©£ŗ
ĒāŃõ»ÆĪļ | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
æŖŹ¼³ĮµķµÄpH | 1.5 | 6.5 | 7.2 |
³ĮµķĶźČ«µÄpH | 3.3 | 9.9 | 9.5 |
£Ø1£©½ž³ö¹ż³ĢÖŠ£¬²»²ÉÓĆĶØČėæÕĘųµÄ·½·Ø½ųŠŠ½Į°č£¬ŌŅņŹĒ·ĄÖ¹½«CuŃõ»Æ½ž³ö£¬ĘäĄė×Ó·½³ĢŹ½ŹĒ__________________”£
£Ø2£©³żīܹż³ĢÖŠ£¬Šæ·Ū»įÓėAs2O3ŠĪ³ÉĪ¢µē³Ų²śÉśAsH3”£øĆĪ¢µē³ŲµÄÕż¼«·“Ó¦Ź½ĪŖ_____”£
£Ø3£©³żĢśŹ±ĻČ¼ÓČėŹŹĮæKMnO4£¬ŌŁ¼ÓČėZnOµ÷½ŚpH”£
¢Ł ³żĢś¹ż³ĢÖŠ£¬ĄķĀŪÉĻ²Ī¼Ó·“Ó¦µÄĪļÖŹn£ØKMnO4£©”Ćn£ØFe2+£©=_________”£
¢Ś ³żĢśŹ±¼ÓČėZnOæŲÖĘ·“Ó¦ŅŗpHµÄ·¶Ī§ĪŖ________________”£
£Ø4£©ČōÉĻŹöĮ÷³ĢÖŠĶ¶ČėµÄKMnO4²»×ćĮ棬Ōņ“żµē½āČÜŅŗÖŠÓŠFeŌŖĖŲ²ŠÓą”£ĒėÉč¼ĘŹµŃé·½°ø¼ÓŅŌŃéÖ¤£ŗ_____________________”£
£Ø5£©¾»»ÆŗóµÄČÜŅŗÓƶčŠŌµē¼«µē½āæÉ»ńµĆļÓµ„ÖŹ”£µē½ā·ĻŅŗÖŠæÉŃ»·ĄūÓƵÄČÜÖŹŹĒ_____”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”放2016½ģ»įÄžĻŲŅ»ÖŠµŚĖÄ“ĪŌĀæ¼”æĢś¼°Ęä»ÆŗĻĪļŌŚČÕ³£Éś»ī”¢Éś²śÖŠÓ¦ÓĆ¹ć·ŗ”£
£Ø1£©øßĢśĖįÄĘ£ØNa2FeO4£©ŹĒĖ®“¦Ąķ¹ż³ĢÖŠµÄŅ»ÖÖŠĀŠĶ¾»Ė®¼Į£¬¹¤ŅµÉĻĄūÓĆNaClO ŗĶNaOHµÄ»ģŗĻČÜŅŗ½«2Fe£ØOH£©3Ńõ»ÆŠŌÖʱøøßĢśĖįÄĘ£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ £»øßĢśĖįÄĘÄÜÓĆ×÷ŠĀŠĶ¾»Ė®¼ĮµÄŌĄķŹĒ £»
£Ø2£©Ńõ»ÆĢśŗģŃÕĮĻøśÄ³Š©ÓĶĮĻ»ģŗĻ£¬æÉŅŌÖĘ³É·ĄŠāÓĶĘį”£ŅŌ»ĘĢśæóĪŖŌĮĻÖĘĮņĖį²śÉśµÄĮņĖįŌüÖŠŗ¬Fe2O3”¢SiO2”¢Al2O3”¢MgOµČ£¬ÓĆĮņĖįŌüÖʱøĢśŗģ£ØFe2O3£©µÄ¹ż³ĢČēĻĀ£ŗ
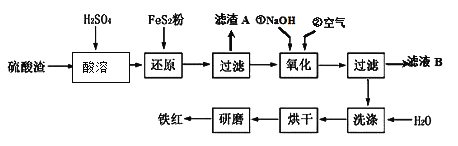
¢ŁĖįČܹż³ĢÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ £¬ £¬ £»”°ĀĖŌüA”±Ö÷ŅŖ³É·ŻµÄ»ÆѧŹ½ĪŖ ”£
¢Ś»¹Ō¹ż³ĢÖŠ¼ÓČėFeS2µÄÄæµÄŹĒ½«ČÜŅŗÖŠµÄFe3 +»¹ŌĪŖFe2 +£¬¶ų±¾Éķ±»Ńõ»ÆĪŖH2SO4£¬ĒėŠ“³öøĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ £»
¢ŪŃõ»Æ¹ż³ĢÖŠ£¬O2”¢NaOHÓėFe2+·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ ”£
¢ÜĪŖĮĖČ·±£ĢśŗģµÄÖŹĮæŗĶ“æ¶Č£¬Ńõ»Æ¹ż³ĢŠčŅŖµ÷½ŚČÜŅŗµÄpHµÄ·¶Ī§ŹĒ £¬
³ĮµķĪļ | Fe£ØOH£©3 | Al£ØOH£©3 | Fe£ØOH£©2 | Mg£ØOH£©2 |
æŖŹ¼³ĮµķpH | 2.7 | 3.8 | 7.6 | 9.4 |
ĶźČ«³ĮµķpH | 3.2 | 5.2 | 9.7 | 12.4 |
Čē¹ūpH¹ż“ó£¬æÉÄÜŅżĘšµÄŗó¹ūŹĒ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŹĀŹµ£¬²»ÄÜÓĆĄÕĻÄĢŲĮŠŌĄķ½āŹĶµÄŹĒ£Ø £©
A£®ŌŚŗĻ³É°±µÄ¹¤ŅµÉś²śÖŠŅŖ¼°Ź±½«Éś³ÉµÄ°±·ÖĄė³öČ„
B£®¶Ō 2HI(g) H2(g)+I2(g)Ę½ŗāĢåĻµ£¬Ōö“óŃ¹ĒææÉŹ¹ŃÕÉ«±äÉī
C£®äåĖ®ÖŠÓŠĻĀĮŠĘ½ŗā Br2+H2OHBr+HBrO£¬µ±¼ÓČė AgNO3 ČÜŅŗŗó£¬ČÜŅŗŃÕÉ«±äĒ³
D£®ŗĻ³É°±·“Ó¦£¬ĪŖĢįøß°±µÄ²śĀŹ£¬ĄķĀŪÉĻ²»ŅĖ²ÉÓĆøßĪĀ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com