
 )与季戊四醇(
)与季戊四醇( )以物质的量之比2:1 反应
)以物质的量之比2:1 反应 .
. 分析 (1)根据盖斯定律,由已知热化学方乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数并进行相应的加减,据此计算;
(2)根据氧化剂CuSO4得到的电子等于还原剂白磷失去的电子来分析;
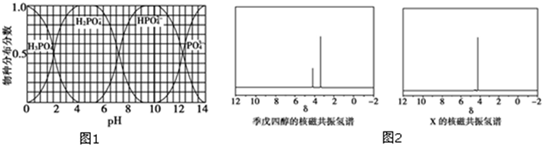
(3)①根据为获得尽可能纯的NaH2PO4,pH应控制从图表中找出H2PO4-分布分数最大值所在区间;溶液中主要含磷物种浓度大小关系可由图表得出;
②HPO42-离子既能发生电离又能发生水解,溶液呈碱性,说明水解程度大于电离程度,根据HPO42-离子和Ca2+离子反应生成沉淀使得水解程度小于电离程度;
(4)根据核磁共振氢谱可知:季戊四醇中有两种氢原子,而新型阻燃剂中间体X中只有一种氢原子,说明三氯氧磷(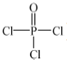 )与季戊四醇(
)与季戊四醇( )以物质的量之比2:1 反应时,季戊四醇中羟基氢全部消失,生成氯化氢酸性气体.
)以物质的量之比2:1 反应时,季戊四醇中羟基氢全部消失,生成氯化氢酸性气体.
解答 解:(1)①2Ca3(PO4)2(s)+10C(s)═6CaO(s)+P4(s)+10CO(g)△H1=+3359.26 kJ•mol-1
②CaO(s)+SiO2(s)═CaSiO3(s)△H2=-89.61kJ•mol-1
①+②×6得2Ca3(PO4)2(s)+6SiO2(s)+10C(s)═6CaSiO3(s)+P4(s)+10CO(g)△H3=△H1+△H2×6=+2821.6kJ•mol-1,
故答案为:+2821.6;
(2)CuSO4中铜的化合价由+2价变为+1价,1个CuSO4得到1个电子,60molCuSO4共得到电子60mol,白磷中磷的化合价由0价变为+5价,1个白磷得到20个电子,所以60molCuSO4能氧化白磷的物质的量为3mol,
故答案为:3mol;
(3)①为获得尽可能纯的NaH2PO4,pH应控制从图表中找出H2PO4-分布分数最大值所在区间,即4~5.5(介于此区间内的任意值或区间均可),溶液中主要含磷物种浓:度大小关系可由图表得出 c(HPO42-)>c(H2PO4-),
故答案为:4~5.5(介于此区间内的任意值或区间均可);c(HPO42-)>c(H2PO4-);
②HPO42-离子既能发生电离又能发生水解,电离反应式为HPO42-?PO43-+H+,水解反应式为HPO42-+H2O?H2PO4-+OH-,溶液呈碱性,说明水解程度大于电离程度;
由于HPO42-离子和Ca2+离子反应生成沉淀:3Ca2++2HPO42-═Ca3(PO4)2↓+2H+,使得水解程度小于电离程度,溶液则显酸性,
故答案为:3Ca2++2HPO42-═Ca3(PO4)2↓+2H+;
(4)核磁共振氢谱可知:季戊四醇中有两种氢原子,而新型阻燃剂中间体X中只有一种氢原子,说明三氯氧磷( )与季戊四醇(
)与季戊四醇( )以物质的量之比2:1 反应时,季戊四醇中羟基氢全部消失,生成氯化氢酸性气体,X的结构简式为:
)以物质的量之比2:1 反应时,季戊四醇中羟基氢全部消失,生成氯化氢酸性气体,X的结构简式为: ;
;
故答案为:①HCl; ② .
.
点评 本题围绕磷及其化合物展开,涉及元素化合物性质、热化学方程式、氧化还原反应判断、离子反应方程式的书写、读图读表、pH控制、核磁共振氢谱等知识,难度中等以上.


科目:高中化学 来源: 题型:选择题
| A. | 同温同压同体积的气体单质所含原子个数相等 | |
| B. | 常温常压下,11.2LO2所含的氧原子数为NA | |
| C. | 摩尔是沟通宏观和微观的桥梁 | |
| D. | 大规模海水淡化采用蒸馏法 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在25℃,101KPa的条件下,将共8L的CO和O2的混合气体通入一个带可自由移动活塞容积可变但压强不变的密闭容器中(如图所示),用电火花点燃充分反应后恢复至原来的条件,测得气体的密度变为原来的$\frac{4}{3}$,求
在25℃,101KPa的条件下,将共8L的CO和O2的混合气体通入一个带可自由移动活塞容积可变但压强不变的密闭容器中(如图所示),用电火花点燃充分反应后恢复至原来的条件,测得气体的密度变为原来的$\frac{4}{3}$,求查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蒸发皿中放入NaCl溶液,加热、蒸发所有水分得到NaCl晶体 | |
| B. | 用10 mL的量筒量取5.2 mL的盐酸 | |
| C. | 用托盘天平称取25.20 g NaCl | |
| D. | 用1 000 mL容量瓶配制450 mL 0.1 mol•L-1的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该分散系能发生丁达尔现象 | B. | 分散质颗粒能透过滤纸 | ||
| C. | 该分散质颗粒大小在1~100 nm之间 | D. | 该分散系很不稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com