
【题目】医用氯化钙可用于生产补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2、2H2O的质量分数为97.0%~103.0%)的主要流程如下:
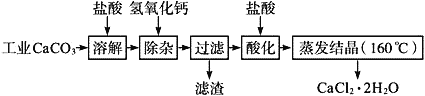
已知:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Al(OH)3 | |
开始沉淀时的pH | 2.3 | 4.0 | 开始溶解时的pH | 7.8 |
完全沉淀时的pH | 3.7 | 5.2 | 完全溶解时的pH | 10.8 |
(1)CaCO3与盐酸反应的离子方程式___________。
(2)“除杂”操作是加入氢氧化钙,调节溶液的pH范围为________,目的是除去溶液中的少量Al3+、Fe2+。
(3)过滤时需用的比玻璃器有__________。
(4)“酸化”操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①防止氢氧化钙吸收空气中的二氧化碳;②防止Ca2+在蒸发时水解;③_______。
(5)蒸发结晶要保持在160℃的原因是__________。
(6)测定样品中Cl-含量的方法是:称取0.750 0 gCaCl2·2H2O样品,溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中;用0.050 00 mol/L AgNO3溶液滴定至终点(用K2Cr2O2),消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需用溶液润洗的仪器有________。
②计算上述样品中CaCl2·2H2O的质量分数为_______。(保留四位有效数字)
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有________;__________。
【答案】CaCO3+2H+=Ca2++CO2↑+H2O5.2≤PH<7.8玻璃棒、烧杯、普通漏斗将溶液中少量的Ca(OH)2转化为CaCl2温度太高,CaCl22H2O会失水滴定管99.91%样品中存在少量NaCl(或少量CaCl22H2O会失水)
【解析】
试题分析:以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙,由制备流程可知,碳酸钙与盐酸反应,溶解后加氢氧化钙除去Al3+、Fe3+等杂质,过滤分离出沉淀,滤液加盐酸除去过量的碱,蒸发结晶可得到CaCl22H2O,但温度过高使CaCl22H2O分解失去结晶水,并结合CaCl22H2O~2Cl-~2AgNO3计算。
解析:(1)CaCO3与盐酸反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O;
(2)根据表中数据可知要除去Al3+、Fe3+等杂质,溶液的pH不能超过7.8,所以范围是5.2≤pH<7.8;
(3)过滤分离出Fe(OH)3、Al(OH)3,需要烧杯、漏斗、玻璃棒;
(4)加入的氢氧化钙是过量的 ,因此酸化时加入盐酸的另一个目的为除去过量的氢氧化钙;
(5)蒸发结晶要保持在160℃,是因温度太高CaCl22H2O会失去结晶水;
(6)①滴定实验中需要润洗的是滴定管;
②称取0.7500g样品并配成250mL溶液,分别取该溶液25.00mL于三个锥形瓶中,用0.05mol/LAgNO3溶液进行三次滴定,消耗 AgNO3溶液的平均体积为20.39mL,由CaCl22H2O~2Cl-~2AgNO3可知,样品中含CaCl22H2O的质量分数为![]() ;
;
②若所测样品 CaCl22H2O的质量分数偏高(忽略其它实验误差),可能的原因之一为Na+没除去析出NaCl,消耗的硝酸银偏大,导致测定结果偏大,也可能是少量CaCl22H2O会失水,导致测定结果偏高。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是( )

A. 电流从右侧电极经过负载后流向左侧电极
B. 负极发生的电极反应式为:N2H4+4OH-+4e-=N2+4H2O
C. 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
D. 该电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用碱式滴定管量取0.1mol·L-1的NaOH溶液,开始时仰视液面读数为1.00mL,取出部分溶液后,俯视液面,读数为11.00mL,该同学在操作中实际取出的液体体积为
A.大于10.00mL B.小于10.00mL C.等于10.00mL D.11.00mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用勒沙特列原理解释的是( )
A.500℃左右比室温更有利于合成氨的反应
B.低压有利于合成氨的反应
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.实验室常用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一同学欲从量筒中取出部分液体,他先俯视凹液面的最低处,读数为50mL,倒出液体后,他又仰视凹液面的最低处,读数为10mL他实际倒出液体的体积为( )
A. 40mL B. 大于40mL C. 小于40mL D. 不一定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在蛋白质溶液中分别进行下列操作或加入下列物质,其中一种与其它三种现象有本质不同的是
A.加硫酸铵的浓溶液 B.加浓硝酸 C.加热 D.加硫酸铜溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治理汽车尾气的方法之一是在汽车排气管上装一个“催化转换器”。发生的化学反应为:2CO+2NO = N2+2CO2 ,其中的氧化剂是
A. NO B.CO C.N2 D.CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,实验测得1.0mol/LNH4HCO3溶液pH=8.0。平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是

A. 常温下Ka1(H2CO3)>Kb(NH3·H2O)>Ka2(H2CO3)
B. pH=13时,溶液中不存在HCO3-的水解平衡
C. pH由8~11时,c(CO32-)·c(H+)/c(HCO3-)不变
D. pH=3时,有c(NH4+)+c(NH3·H2O) =c(HCO3-)+c(CO32-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是()

A. 钠与W可能形成Na2W2化合物
B. 由Z与Y组成的物质在熔融时能导电
C. W得电子能力比Q强
D. X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com