
【题目】某化学兴趣小组试利用镁铝合金废料(不含其它杂质)制备硫酸铝晶体,其实验流程如图:
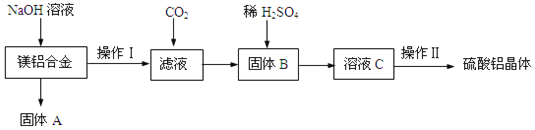
(1)在镁铝合金中加入NaOH溶液,发生反应的离子反应方程式为_____,固体B的化学式_____。
(2)操作Ⅱ包含的实验步骤有:_____、冷却结晶、过滤、洗涤、干燥。
(3)若初始时称取的镁铝合金废料的质量为7.65 g,得到固体A的质量为3.6 g,硫酸铝晶体的质量为49.95 g(假设每一步的转化率均为100%)。计算所得硫酸铝晶体的化学式为_____。( 在答题卷上写出计算过程)
(4)另取7.65 g该镁铝合金废料溶于400mL 3mol/L盐酸后,滴入3mol/LNaOH溶液,使所得沉淀中的Al(OH)3完全溶解,则滴入NaOH溶液的体积最少为_____mL(在答题卷上写出计算过程)。
【答案】2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Al(OH)3 蒸发浓缩 Al2(SO4)318H2O 450
【解析】
向镁铝合金中加入足量氢氧化钠溶液,发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,镁不反应,固体A为Mg,采用过滤的方法进行分离,向滤液中通入二氧化碳,使偏铝酸钠转化为氢氧化铝沉淀,再通过过滤进行分离,固体B为氢氧化铝,氢氧化铝与硫酸反应得到硫酸铝溶液,再经过蒸发浓缩、冷却结晶、洗涤、干燥得到硫酸铝晶体;据此分析。
(1)Al和氢氧化钠溶液生成可溶性的偏铝酸钠与氢气,镁不反应,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,由上述分析可知,固体B为Al(OH)3,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;Al(OH)3;
(2)从溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,故答案为:蒸发浓缩;
(3)Al的质量为7.65g-3.6g=4.05g,其物质的量为![]() =0.15mol,设硫酸铝晶体化学式为:Al2(SO4)3nH2O,根据Al元素守恒,硫酸铝晶体的物质的量为
=0.15mol,设硫酸铝晶体化学式为:Al2(SO4)3nH2O,根据Al元素守恒,硫酸铝晶体的物质的量为![]() =0.075mol,故硫酸铝晶体的相对分子质量为
=0.075mol,故硫酸铝晶体的相对分子质量为![]() =666,则54+96×3+18n=666,解得n=18,故该硫酸铝晶体的化学式为:Al2(SO4)318H2O,故答案为:Al2(SO4)318H2O;
=666,则54+96×3+18n=666,解得n=18,故该硫酸铝晶体的化学式为:Al2(SO4)318H2O,故答案为:Al2(SO4)318H2O;
(4)Mg的质量为3.6g,其物质的量为0.15mol,Al的质量为4.05g,其物质的量为0.15mol,若该Mg、Al混合物溶于400mL 3mol/L盐酸后,n(HCl)=0.4L×3mol/L=1.2mol,消耗n(HCl)=2n(Mg)+3n(Al)=2×0.15mol+3×0.15mol=0.75mol,剩余HCl为1.2mol-0.75mol=0.45mol,滴入NaOH溶液,使所得沉淀中无Al(OH)3,则发生H++OH﹣=H2O,Mg2++2OH﹣=Mg(OH)2↓、Al3++4OH﹣=AlO2﹣+2H2O,则需要n(NaOH)=n(HCl)+2n(Mg)+4n(Al)=0.45mol+2×0.15mol+4×0.15mol=1.35mol,V(NaOH)=![]() =0.45L=450mL,故答案为:450。
=0.45L=450mL,故答案为:450。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】元素周期表中第三、四周期的某些元素在生产、生活中有着广泛的应用。
(1)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
①钒的价电子排布图是___________;
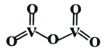
②V2O5是一种常见的催化剂,常用在SO2转化为SO3的反应中。V2O5的结构式如图所示,则V2O5分子中σ键和π键数目之比为____________;若将V2O5溶解在NaOH溶液中,可得到锐酸钠(Na3VO4),该盐中阴离子的立体构型为_____________,写出与VO43-空间构型相同的一种阳离子____________(填化学式)。
(2)氯化铝在有机化学中有很广泛的应用。无水氯化铝在177.8℃时升华,蒸气或熔融状态以Al2Cl6形式存在。下列关于氯化铝的推断错误的是_______。
a.氯化铝是分子晶体 b.Al2Cl6中Al是sp2杂化
c.氯化铝难溶于有机溶剂 d.Al2Cl6中存在配位键
(3)FeCO3可作补血剂,CoCO3可用于陶瓷工业的着色剂。已知:r(Fe2+)为61pm,r(Co2+)为65pmo在隔绝空气条件下分别加热FeCO3和CoCO3时,FeCO3的分解温度低于CoCO3,其原因是_________________________。
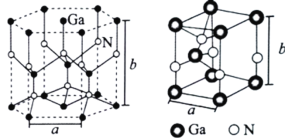
(4)GaN是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaN晶胞结构如图所示。已知六棱柱底边边长为acm,高为bcm,阿伏加德罗常数的值为NA。则晶胞中Ga原子采用的密堆积方式为______________,每个Ga原子周围距离最近的Ga原子数目为____;GaN的密度为_____________gem-3(用含a、b、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在20.00 mL 0.10 mol/LCH3COOH溶液中滴入0.10 mol/LNaOH溶液,溶液pH与NaOH溶液体积的关系如图所示。下列说法正确的是
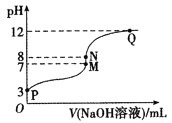
A.T℃时,CH3COOH的电离平衡常数Ka=1.0×10-3
B.M点对应的NaOH溶液的体积为20.00 mL
C.N点所示溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.N点与Q点所示溶液中水的电离程度:N>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:(已知Cd的金属活动性介于Zn和Fe之间)
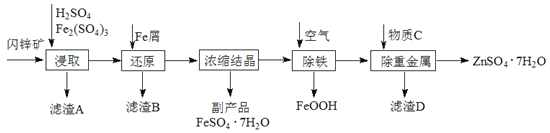
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为________。
(2)浸取过程中Fe2(SO4)3的作用是_______________,浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为____________________________________________。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为_______________________。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是____________________________________。
(4)置换法除重金属离子是Cd2+,所用物质C为_________。
(5)硫酸锌的溶解度与温度之间的关系如下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为__________、__________、过滤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的叙述一定不正确的是
A. 向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
B. KAl(SO4) 2·12H2O溶于水可形成 Al(OH)3胶体
C. NH4Cl与Ca(OH)2混合加热可生成NH3
D. Cu与FeCl3溶液反应可生成CuCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
| 甲 | 乙 | 丙 |
A | Al | HCl | NaOH |
B | NH3 | O2 | HNO3 |
C | SiO2 | NaOH | HF |
D | SO2 | Ca(OH)2 | NaHCO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为一些物质之间的转化关系,其中部分反应中反应物或生成物未列全。已知A、H、I、K均为家庭厨房中的常见物质,其中A是食品调味剂,H是消毒剂的有效成分,I、K可用作食品发泡剂。B是一种有机酸盐,E、F、G均为氧化物,L是红褐色沉淀。

根据以上信息,回答下列问题:
(1)B的组成元素为_____。
(2)鉴别等物质的量浓度的I、K稀溶液的实验方法为_____。
(3)G→J的离子方程式为_____。
(4)M是含氧酸盐,反应①中H、L、D的物质的量之比为3:2:4,则M的化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数数值如下:2NO(g) ![]() N2(g)+O2(g) K1=1×1030 2H2(g)+O2(g)
N2(g)+O2(g) K1=1×1030 2H2(g)+O2(g) ![]() 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) ![]() 2CO(g)+O2(g) K3=4×10-92 以下说法正确的是
2CO(g)+O2(g) K3=4×10-92 以下说法正确的是
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)/ c(NO)
B.常温下,NO、H2O、CO2三种化合物分解放出O2的进行程度由大到小的顺序为NO>H2O>CO2
C.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
D.以上说法都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向2L密闭容器中加入2molN2和10molH2,发生反应N2(g)+3H2(g)![]() 2NH3(g),2min时测得剩余N2为1mol,下列化学反应速率表示不正确的是( )
2NH3(g),2min时测得剩余N2为1mol,下列化学反应速率表示不正确的是( )
A. v(N2)=0.25 mol·L-1·min-1
B. v(H2)=0.75 mol·L-1·min-1
C. v(NH3)=1 mol·L-1·min-1
D. v(NH3)=0.5 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com