
【题目】实验室需要0.1 mol·L-1 NaOH溶液450mL和0.5 mol·L-1硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题:
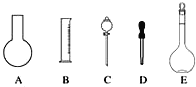
(1)如图所示的仪器中配制溶液肯定不需要的是_______(填序号),配制上述溶液还需用到的玻璃仪器是_________(填仪器名称)。
(2)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为______g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度_____(填“偏高”、“偏低”或“不变”);
③若NaOH固体溶解后立即移入容量瓶→洗涤烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度________(填“偏高”、“偏低”或“不变”)。
(3)在配制硫酸溶液时:
①需量取质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积_______ml;
②在配制硫酸溶液时需先在烧杯中将浓硫酸进行稀释,稀释时的操作方法是_________________
【答案】AC 烧杯、玻璃棒 2.0 偏低 偏高 13.6 将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌
【解析】
(1)通过溶解或者稀释配制溶液需要五种玻璃仪器:量筒(稀释配制)、烧杯、玻璃棒、胶头滴管、容量瓶,所以用不到的仪器:烧瓶和分液漏斗;还缺少的仪器:烧杯、玻璃棒;
故答案为:AC;烧杯、玻璃棒;
(2)①需要0.1molL1NaOH溶液450mL,应选择500mL容量瓶,需要氢氧化钠质量为:0.1molL1×0.5L×40g/mol=2.0g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,导致溶质的物质的量偏小,则所得溶液浓度偏低;
③若NaOH固体溶解后立即移入容量瓶→洗涤烧杯→洗涤液移入容量瓶→定容,未冷却到室温,根据热胀冷缩原理,定容冷却后,溶液体积偏小,则所得溶液浓度偏高;
故答案为:2.0;偏低;偏高;
(3)①质量分数为98%、密度为1.84gcm3的浓硫酸,物质的量浓度为:![]() =18.4mol/L,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:18.4mol/L×V=0.5molL1×500mL,解得V=13.6mL;
=18.4mol/L,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:18.4mol/L×V=0.5molL1×500mL,解得V=13.6mL;
②浓硫酸稀释的正确操作为:将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌;
故答案为:13.6;将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌。


科目:高中化学 来源: 题型:
【题目】(1)1mol H2SO4中含有_____个硫原子,_____mol O。
(2)写出下列物质在水溶液中的电离方程式
HCl:_______________NaHSO4:____________________
(3)写出下列化学反应的方程式
呼吸面具中过氧化钠与二氧化碳反应的化学方程式_________________
氢氧化亚铁白色沉淀迅速变为灰绿色,最终变为红褐色的反应的化学方程式____________________
印刷电路板处理时铜与氯化铁溶液反应的离子方程式_______________________
(4)配平下列方程式:
_____I-+_____IO3-+ _____H+—_____I2+_____H2O
_____NH4ClO4——_____N2↑+_____O2↑+_____HCl+_____H2O
(5)用单线桥法或双线桥法表示该反应转移电子的方向和数目并填空:
Cu+4 HNO3(浓)= Cu(NO3)2+ 2 NO2↑+ 2H2O__________________
HNO3的作用是__________,发生氧化反应,氧化产物是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在周期表中的位置关系如图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。

(1)X元素在元素周期表中的位置________。
(2)X、Y、Z元素的简单气态氢化物中,稳定性最差的是________(用分子式表示)。
(3)Y、Z、W三种元素对应的离子中,半径由大到小的顺序____________(用离子符号表示)。
(4)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式_______________。关于该电池的下列说法,正确的是_________。

A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(5)X2Z42-能被酸性KMnO4氧化,请填写相应的离子,并给予配平:
_____ ______+______MnO4- + ________H+ = ______CO2 + _______Mn2++______H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用Cl-取代[Co(NH3)6]3+离子中的NH3方法,制备配合物X:[Co(NH3)5Cl]Cl2。实验过程如下:
CoCl2﹒6H2O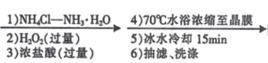 [Co(NH3)5Cl]Cl2晶体
[Co(NH3)5Cl]Cl2晶体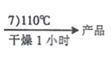
已知:
a.配合物X 能溶于水,且溶解度随温度升高而增大。
b.[Co( NH3)5Cl]2+离子较稳定,但加碱再煮沸可促进其解离:[Co(NH3)5Cl]2+![]() Co3++5NH3+Cl。
Co3++5NH3+Cl。
c.H2O2参与反应时,明显放热。
请回答:
(1)制备配合物X的总反应方程式为___________。
(2)“1) NH4Cl-NH3H2O”时,如果不加NH4Cl固体,对制备过程的不利影响是____。
(3)“2)H2O2”加H2O2 时应选择 _________(填序号)。
A.冷水浴 B.温水浴( ≈60°C)
C.沸水浴 D.酒精灯直接加热
(4)本实验条件下,下列物质均可将 Co(II)氧化为 Co(III)。其中可替代“2)H2O2”的是_____________(填序号)。
A.O2 B.KMnO4 溶液 C.Cl2 D.HNO3
(5)实验小组用以下思路验证配合物 X 的组成:取一定量 X 加入过量浓 NaOH 溶液,煮沸,将生成的NH3 通入一定量的稀硫酸中,再用NaOH 标准溶液滴定剩余 H2SO4 。从以下涉及碱式滴定管的操作中,选择正确操作并排序(润洗只操作一次即可):

检漏→水洗→加标准液,润洗内壁→___________→_________→_________→_________→……
a.从上口倒出润洗液
b.保持滴定管夹水平,平视滴定管刻度读数
c.装标准溶液,调液面,静置半分钟
d.滴定
e.取下滴定管,竖直,平视滴定管刻度读数
f.从下口放出润洗液
(6)下列关于实验过程的叙述,正确的是_____________(填序号)。
A.“4)70℃”水浴加热,有利于获得颗粒较大的晶体
B.抽滤后,应该用热水洗涤晶体
C.可用 AgNO3和稀HNO3 检验配合物X 是否已经洗净
D.抽滤结束,可先打开活塞K,再关掉抽气泵
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生的反应。钠及其氧化物的物质的量 均为0.1 mol,水的质量为100 g。下列说法正确的是

A.甲、乙、丙都属于氧化还原反应
B.甲反应的离子方程式为Na+2H2O![]() Na++2OH-+H2↑
Na++2OH-+H2↑
C.丙充分反应,能产生0.05 mol O2,转移电子0.1 mol
D.甲、乙、丙充分反应后所得溶液的质量分数分别为w1、w2、w3,则2w1=w2=w3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是1mol金属镁和卤素反应的ΔH(单位:kJ·molˉ1)示意图,反应物和生成物均为常温时的稳定状态。下列选项中不正确的是
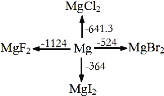
A.电解MgCl2制Mg是吸热反应
B.MgBr2与Cl2反应的ΔH<0
C.MgF2(s)+Br2(l) = MgBr2(s)+F2(g) ΔH=+600kJ·molˉ1
D.化合物的热稳定性顺序:MgI2>MgBr2>MgCl2>MgF2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g) ![]() NH3(g) △H 的反应机理如图所示,图中“吸”表示各气态物质在催化剂表面吸附。下列说法错误的是
NH3(g) △H 的反应机理如图所示,图中“吸”表示各气态物质在催化剂表面吸附。下列说法错误的是
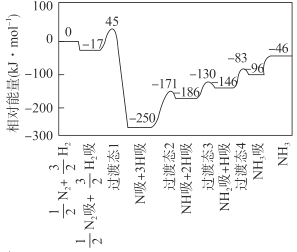
A.该反应的△H = -46 kJ·mol- 1
B.该反应机理中最大活化能为79 kJ·mol- 1
C.升高温度,该反应过渡态的能量会增大
D.该反应达到平衡后增大压强反应正向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,A的单质为密度最小的气体,B、W同周期,A、D同主族,A与W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为______________。写出E的最高价氧化物的水化物与D的最高价氧化物的水化物反应的离子方程式___________________________。
(2)由A、W元素组成的18电子分子的电子式为__________________________。
(3)D的一种氧化物可与B的最高价氧化物反应生成W的单质,试写出反应的化学方程式____________________________。
(4)向含有Fe2+和淀粉KI的溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀生成。当消耗2mol I- 时,共转移3mol电子,该反应的离子方程式是_______________。
(5)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,DA能与水反应放氢气,若将1mol DA和1mol E单质混合加入足量的水,充分反应后生成气体的体积是_________L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于有机合成、染料、颜料、催化剂等工业。它是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸,可溶于氨水、浓盐酸,并生成配合物NH4[CuCl2];能在空气中迅速被氧化成绿色;见光则分解,变成褐色。下图是实验室制备氯化亚铜的流程图及实验装置图。
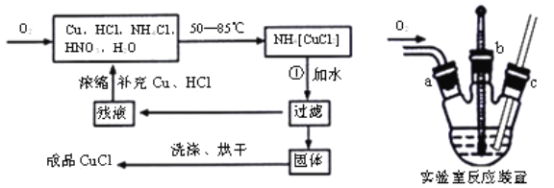
实验药品:铜丝20g、氯化铵20g、65%硝酸l0mL、36%盐酸15mL、水。
(1)请写出①的化学方程式____________________________________。
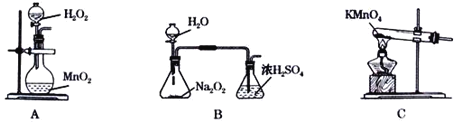
(2)本实验中通入O2的速率不宜过大,宜选择下图中的____(填字母序号)方案,并说明选择该装置的理由__________________________________________。
(3)电炉加热升温至50℃时停止加热,反应快速进行,当烧瓶中液面上方的现象为_____时,停止通入氧气,打开瓶塞,沿C口倾出反应液于l000mL大烧杯中,加水500mL,即刻有大量白色沉淀析出。
(4)关于该实验过程中,下列说法正确的是_________________。
A 实验开始时,温度计显示反应液温度可能低于室温。
B 流程中过滤操作,可以采用真空抽滤的方式,洗涤固体可以用95%的酒精。
C 该实验流程中,残液中补充HCl的主要作用是抑制产物的水解。
D 反应装置中使用长导管的目的是防止三颈烧瓶内气压过大。
(5)氯化亚铜的定量
①称取成品0.25g置于预先放入玻璃珠30粒和l0mL过量的FeCl3溶液的250mL锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.l0 mol·L-1硫酸铈标准溶液滴至绿色出现为终点并记录读数,再重复实验二次,测得数据如下表。(已知:CuCl + FeCl3 = CuCl2 + FeCl2 ,Fe2+ + Ce4+ = Fe3+ + Ce3+)
实验序号 | 1 | 2 | 3 |
滴定起始读数(mL) | 0.75 | 0.50 | 0.80 |
滴定终点读数(mL) | 24.70 | 24.95 | 24.85 |
④数据处理:计算得CuCl的纯度为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com