
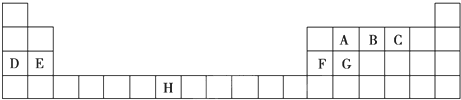
分析 由元素在周期表中的位置可知,A为C元素,B为N元素,C为O元素,D为Na元素,E为Mg元素,F为Al元素,G为Si元素,H为Mn元素;
(1)同周期自左而右元素的第一电离能呈增大趋势,但ⅡA族最外层为ns能级容纳2个电子,为全满确定状态,能量较低,第一电离能高于同周期相邻元素,ⅤA族np能级容纳3的电子,为半满稳定状态,能量较低,第一电离能也高于同周期相邻元素,同主族自上而下电离能降低;
(2)Mn的核外有25个电子,根据电子排布规律书写;
(3)根据中心原子C原子价层电子对数、孤电子对数,确定杂化方式,A的最高价氧化物分子为二氧化碳,属于直线形分子;
(4)D的氯化物为NaCl,是离子晶体,G的氯化物为SiCl4,是分子晶体,据此判断;
(5)元素C与元素G形成的化合物为二氧化硅,根据晶体中的构成微粒判断;二氧化硅中只存在共价单键;
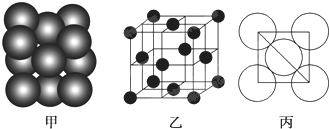
(6)根据图甲可知,该类型为面心立方最密堆积,配位数=3×$\frac{1}{2}$×8=12.
解答 解:由元素在周期表中的位置可知,A为C元素,B为N元素,C为O元素,D为Na元素,E为Mg元素,F为Al元素,G为Si元素,H为Mn元素;
(1)同周期自左而右元素的第一电离能呈增大趋势,但ⅡA族最外层为ns能级容纳2个电子,为全满确定状态,能量较低,第一电离能高于同周期相邻元素,ⅤA族np能级容纳3的电子,为半满稳定状态,能量较低,第一电离能也高于同周期相邻元素,同主族自上而下电离能降低,则N、Na、Al、Si的第一电离能由小到大的顺序为Na<Al<Si<N;
故答案为:Na<Al<Si<N;
(2)Mn的核外有25个电子,其电子排布式为:1s22s22p63s23p63d54s2;
故答案为:1s22s22p63s23p63d54s2;
(3)A的最简单氢化物分子为CH4,中心原子C原子价层电子对数为4,没有孤电子对,其杂化方式为sp3,A的最高价氧化物分子为二氧化碳,属于直线形分子;
故答案为:sp3;直线形;
(4)D的氯化物为NaCl,是离子晶体,G的氯化物为SiCl4,是分子晶体,离子晶体的熔点高于分子晶体,所以NaCl的熔点高于SiCl4,
故答案为:高;NaCl是离子晶体,SiCl4是分子晶体;
(5)元素C与元素G形成的化合物为二氧化硅,二氧化硅晶体是有氧原子和硅原子形成的空间网状结构的晶体属于原子晶体;二氧化硅中只存在于共价单键,属于σ键;
故答案为:原子晶体;A;
(6)根据图片知,Al单质为面心立方最密堆积,Al原子配位数配位数=3×$\frac{1}{2}$×8=12,由图2可知占据顶点和面心,则个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,
故答案为:12;4.
点评 本题是对物质结构的考查,涉及元素周期表、核外电子排布、杂化轨道、分子结构、电负性、晶体类型、氢化物稳定性比较等,难度中等,注意把握元素在周期表中的位置、元素的性质等,侧重于元素周期表和周期律知识的综合应用的考查.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
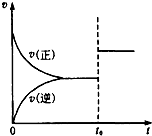 可逆反应aX(g)+bY(g)?cZ(g),在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)和时间(t)的关系如图所示.下列说法中正确的是( )
可逆反应aX(g)+bY(g)?cZ(g),在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)和时间(t)的关系如图所示.下列说法中正确的是( )| A. | 若a+b=c,则t0时只增大了反应物的浓度 | |
| B. | 若a+b=c,则t0时只升高了温度 | |
| C. | 若a+b≠c,则t0时只增大了容器的压强 | |
| D. | 若a+b≠c,则t0时只加入了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
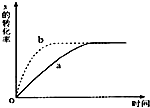 如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 升高温度 | B. | 加大X的投入量 | C. | 缩小体积 | D. | 减小N的投入量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
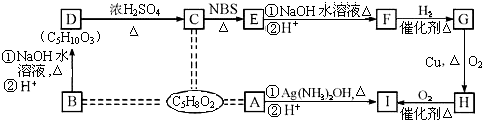
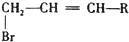
 、HOOCCH2CH2CH2CHO.
、HOOCCH2CH2CH2CHO.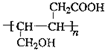 .
.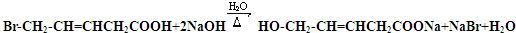 .
.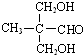 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广节能灯和LED灯泡替代一般白炽灯 | |
| B. | 大力发展地铁,轻轨电车等城市公共交通 | |
| C. | 鼓励购买大排量家庭用燃油汽车 | |
| D. | 提倡使用手帕,减少纸巾的使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
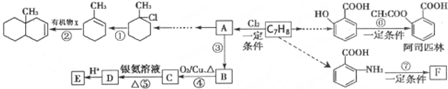

 (苯胺,易被氧化)
(苯胺,易被氧化)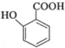 可选用的试剂有(填标号).a.FeCl3溶液 b.浓溴水 c.Na D.NaHCO3溶液
可选用的试剂有(填标号).a.FeCl3溶液 b.浓溴水 c.Na D.NaHCO3溶液 ;
; $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$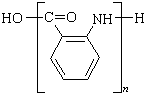 +(n-1)H2O.
+(n-1)H2O. 的合成路线流程图(无机试剂任用)
的合成路线流程图(无机试剂任用) $→_{△}^{浓硫酸、浓硝酸}$
$→_{△}^{浓硫酸、浓硝酸}$ $\stackrel{酸性高锰酸钾溶液}{→}$
$\stackrel{酸性高锰酸钾溶液}{→}$ $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ .合成路线流程图示例如下:CH2=CH2$→_{催化剂,△}^{H_{2}O}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
.合成路线流程图示例如下:CH2=CH2$→_{催化剂,△}^{H_{2}O}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
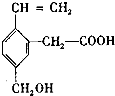 ,这种有机物不可能具有的性质是( )
,这种有机物不可能具有的性质是( )| A. | 能使酸性KMnO4溶液褪色 | B. | 能发生酯化反应 | ||
| C. | 能跟NaOH溶液反应 | D. | 不能发生取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com