
| A. | 甲苯能使酸性高锰酸钾溶液褪色 | |
| B. | 甲苯与浓硫酸和浓硝酸混酸反应生成2,4,6-三硝基甲苯 | |
| C. | 1mol甲苯能与3mol氢气发生加成反应 | |
| D. | 甲苯可以燃烧并产生浓烈的黑烟 |
分析 A、苯、甲烷不能被酸性KMnO4溶液氧化,甲苯能被酸性KMnO4溶液氧化为苯甲酸;
B、甲基影响苯环,则甲苯中苯环上的H易被取代;
C、1mol苯也能和3mol氢气发生加成反应;
D、甲苯燃烧产生浓烈的黑烟与其碳的百分含量有关.
解答 解:A、甲苯可看作是CH4中的1个H原子被-C6H5取代,苯、甲烷不能被酸性KMnO4溶液氧化使其褪色,甲苯能被酸性KMnO4溶液氧化为苯甲酸,苯环未变化,侧链甲基被氧化为羧基,说明苯环影响甲基的性质,故A正确;
B、甲基影响苯环,则甲苯中苯环上的H易被取代,甲苯苯环上氢原子比苯分子中的氢原子更易被硝基取代,可说明或原子与原子团间的相互影响会导致物质的化学性质不同,故B正确;
C、1mol甲苯能和3mol氢气发生加成反应,而1mol苯也能和3mol氢气发生加成反应,故不能说明甲基和苯环之间的影响,故C错误;
D、甲苯燃烧产生浓烈的黑烟与其碳的百分含量很高有关,与苯环和侧链之间的影响无关,故D错误.
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、原子或原子团的相互影响为解答的关键,侧重常见有机物结构、性质的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | |
| 乙炔 | CaCO3$\stackrel{①850-1100℃}{→}$CaO$→_{1100℃}^{②+C、电炉}$CaC2$\stackrel{③饱和食盐水}{→}$C2H2 |
| 乙烯 | 来源于石油裂解气 |
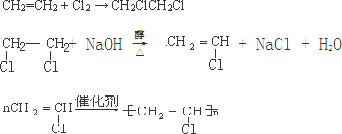 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备1,2二溴乙烷的反应原理如下:
实验室制备1,2二溴乙烷的反应原理如下:| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
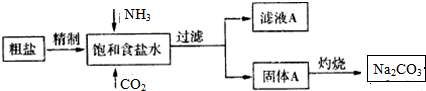
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol任何物质都含有NA个原子 | |
| B. | 硫酸的摩尔质量是98克 | |
| C. | 1 mol氮气的质量是28克 | |
| D. | 摩尔是国际单位制中七个基本物理量之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某温度时,在一个5L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.试根据图中数据,填写下列空白:
某温度时,在一个5L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.试根据图中数据,填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com