
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
科目:高中化学 来源:不详 题型:单选题
| A.分别和盐酸反应时,混合物的耗酸量大 |
| B.分别和足量盐酸反应时,混合物放出的CO2多 |
| C.分别配制成等体积溶液,混合物的pH值大 |
| D.分别配制成等体积溶液,混合物的Na+的物质的量大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
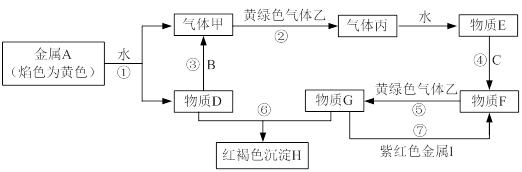
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.小苏打可与酸反应,可用作治疗胃酸过多的药剂 |
| B.氯化铝是电解质,可电解其水溶液获得金属铝 |
| C.SO2具有漂白性,可用于将银耳漂白为“雪耳” |
| D.二氧化硅具有导电性,可用于生产光导纤维 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.三者对应的氧化物均为碱性氧化物 |
| B.三者的单质放置在空气中均只生成氧化物 |
| C.Fe2O3与Fe3O4互为同素异形体 |
| D.常温下三者加入浓硫酸中均无明显现象 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
| 实验序号 | a | b | c |
| 合金质量/mg | 510 | 765 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
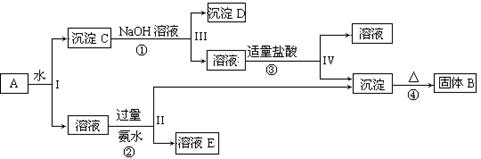
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验探究内容 | 实验用品 |
| A | 铜丝在氯气中燃烧 | 坩埚钳、燃烧匙、氯气、铜丝 |
| B | 铝热反应 | 铁架台、大蒸发皿、普通漏斗、铝粉、Fe2O3 |
| C | 实验室制备氨气 | 试管、集气瓶、酒精灯、NH4Cl、Ca(OH)2 |
| D | 用KMnO4晶体配制500mL0.1mol·L-1KMnO4溶液 | 容量瓶、烧杯、玻璃棒、酸式滴定管、KMnO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com