
【题目】2019年是门捷列夫提出元素周期表150周年。已知在元素周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。W与Q可以形成一种高温结构陶瓷材料,W的氯化物分子呈正四面体结构。回答下列问题:
(1)元素X在元素周期表中的位置_________
(2)W的氧化物的晶体类型是____________
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是________
(4)这5个元素的氢化物分子中:
①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)_______
②电子总数相同的氢化物的化学式和立体结构分别是_________
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是_________。
【答案】第三周期第ⅤA族 原子晶体 As2S5 NH3> AsH3 >PH3 电子数相同的有SiH4(正四面体)、PH3(三角锥型)和H2S(V形) SiCl4 + 4NH3 = Si(NH2)4 + 4HCl, 3Si(NH2)4 = 8NH3 + Si3N4
【解析】
W的氯化物分子呈正四面体结构,应为SiCl4或CCl4,又W与Q可以形成一种高温结构陶瓷材料,可推断W为Si,Q为N元素;元素Q、R、W、Y与元素X相邻,Y的最高化合价氧化物的水化物是强酸,则Y为S,X为P,R为As元素。
根据分析可知,Q为N,R为As,W为Si,Y为S,X为P元素。
(1)P的原子序数为15,位于元素周期表中第三周期第ⅤA族;
(2)W的氧化物为二氧化硅,二氧化硅属于原子晶体;
(3)As的最高价为+5价,则As和S形成的二元化合物的化学式为As2S5;
(4)①氨气分子间存在氢键,其沸点最高;AsH3、PH3都属于分子晶体,相对分子质量越大沸点越高,则沸点大小为:NH3>AsH3>PH3;
②这5个元素的氢化物分子中,SiH4、PH3和H2S的电子数均为18,价电子对数分别为![]() ,
,![]()
![]() ,孤对电子对分别为0,1,2,因此其空间结构分别为正四面体,三角锥和V形;
,孤对电子对分别为0,1,2,因此其空间结构分别为正四面体,三角锥和V形;
(5)由信息可知,四氯化硅与氨气反应生成W(QH2)4和HCl,Si(NH2)4在高温下分解生成氨气和氮化硅,反应方程式分别为:SiCl4+4NH3=Si(NH2)4+4HCl、3 Si(NH2)4=8NH3+Si3N4。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法正确的是( )
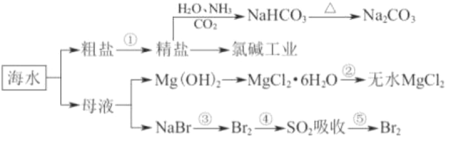
A. 工业上通过电解饱和MgCl2溶液制取金属镁
B. 第①步中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的药品顺序为NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
C. 在③、④、⑤步骤中,溴元素均被氧化
D. 制取NaHCO3的反应是利用其溶解度比较小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是元素周期表主族元素的一部分,短周期元素X的最高正价是+5价,Y单质可在空气中燃烧。
W | X | Y |
Z |
(1)Z的元素符号是________,原子结构示意图是_________。
(2)W的最高价氧化物不溶于水,但能溶于烧碱溶液,反应的化学方程式为_________。
(3)探寻同一族元素性质的一些共同规律,是学习化学的重要方法之一。在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式。
编号 | 性质推测 | 化学方程式 |
示例 | 氧化性 | H2ZO3+4HI=Z↓+2I2+3H2O |
1 | ____ | ____ |
2 | ____ | ____ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿( 主要成分为FeTiO3 和少量Fe2O3 )进行钛白粉和LiFePO4 的联合生产工艺如下图所示:
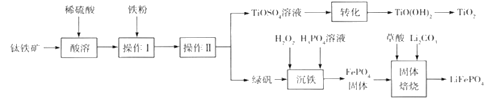
回答下列问题:
(1) LiFePO4中Fe的化合价是_______________________。
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________。
(3)用离子方程式表示操作I加入铁粉的目的:__________________________。操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________。
(4)TiO2+易水解,则其水解的离子方程式为______________________;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________。
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+ 沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______mol/L[已知:该温度下,Ksp(FePO4)=1.0×10-22]。
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是
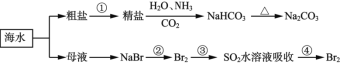
A.制取NaHCO3的反应是利用其溶解度小于NaCl
B.侯氏制碱应先通NH3再通CO2
C.在第②、③、④步骤中,溴元素均被氧化
D.③④的目的是进行溴的富集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体的组成可表示为H2C2O4·xH2O,为测定x值,进行下述实验:
实验1:准确称取Wg草酸晶体配成100ml水溶液;
实验2:用浓度为0.100molL-1KMnO4溶液滴定所配制的草酸溶液,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+ 10CO2↑+2MnSO4+8H2O。
试回答下列问题:
(1)实验1中,配制100ml草酸水溶液所需要的一组仪器是________(填相应编号)
A、0.001g的电子天平 B、50ml酸式滴定管 C、100ml量筒 D、100ml容量瓶 E、烧杯 F、胶头滴管 G、锥形瓶
(2)实验2中H2C2O4·xH2O中x值的测定是利用氧化还原反应滴定法
①其中正确操作步骤的顺序为___________
a.用移液管取用25.00ml所配的草酸溶液置于锥形瓶中,加适量的稀硫酸。
b.把盛有KMnO4标准液的滴定管固定好,调节滴定管尖嘴使之充满液体
c.取KMnO4标准液注入滴定管中至“0”刻度以上
d.调节液面至“0”或“0”刻度以下,记下读数
e.把标准KMnO4溶液润洗滴定管2~3次
f.把锥形瓶放在滴定管下面,用KMnO4标准液滴定至终点并记下滴定管的读数
②下列关于滴定分析,正确的是________________。
A. 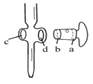 图中,应将凡士林涂在旋塞的a端和旋塞套内的c端
图中,应将凡士林涂在旋塞的a端和旋塞套内的c端
B. 滴定前,锥形瓶和滴定管均须用标准溶液润洗
C. 将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D. 滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
E. 滴定到终点时俯视读取数据,测得的x值偏大
③图中滴定终点时显示的读数为_______ mL。
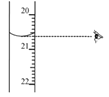
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+3H2(g)2NH3(g)的能量变化如图所示,a、b均为正值,单位是kJ,下列说法正确的是
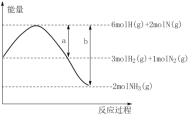
A.N2(g)+3H2(g)2NH3(g) △H=(a-b)kJ·mol-1
B.NH3(g)![]() N2(g)+
N2(g)+![]() H2(g) △H=(b-a)kJ·mol-1
H2(g) △H=(b-a)kJ·mol-1
C.NH3中氮氢键键能为bkJ·mol-1
D.压强越大,该反应的△H越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述正确的是( )
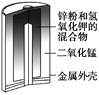
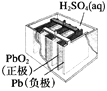
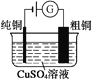
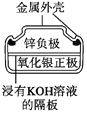
图1 碱性锌锰电池 图2 铅—硫酸蓄电池 图3 电解精炼铜 图4 银锌纽扣电池
A. 图1所示电池中,MnO2的作用是催化剂
B. 图2所示电池放电过程中,硫酸浓度不断增大
C. 图3所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图4所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示,电极为惰性电极。已知海水中含 Na+、Cl–、Ca2+、Mg2+、SO42–等离子。下列叙述中正确的是
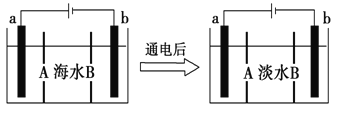
A.A 膜是阳离子交换膜
B.通电后,b 电极上产生无色气体,溶液中出现白色沉淀
C.通电后,海水中阴离子往 b 电极处移动
D.通电后,a 电极的电极反应式为 4OH––4e–=O2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com