
| A. | 放电过程中Li+向正极移动 | |
| B. | 可加入硫酸以提高电解质的导电性 | |
| C. | 充电时,Li+向阳极移动 | |
| D. | 放电时,负极反应式为:2Li0.35NiO2+Li++e-═2Li0.85NiO2 |
分析 据锂离子电池的电池反应式为:Li+2Li0.35NiO2$?_{充电}^{放电}$2Li0.85NiO2,可知,放电时,Li的化合价升高,被氧化,为原电池的负极,负极的电极反应式:Li-e-=Li+,阳离子移向正极;充电时,阳离子移向阴极;由于Li可以与硫酸反应,故不能加入硫酸,据此分析解答.
解答 解:A.放电时,Li+向正极移动,故A正确;
B.Li很活泼,会与硫酸反应,所以不能加入硫酸,故B错误;
C.充电时,Li+向阴极移动,故C错误;
D.放电时,负极反应:Li-e-═Li+,正极反应:2Li0.35NiO2+e-+Li+═2Li0.85NiO2,故D错误;
故选:A.
点评 本题考查电化学的热点-锂离子电池,为高频考点,注意根据总反应式判断出正负极和阴阳极的反应,从化合价变化的角度分析,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 物质微粒数 | 溶质的质量分数 | 标准状况下气体的摩尔体积 | 某物质的质量 |
| 阿伏伽德罗常数 | 溶液体积 | 标准状况下气体的体积 | 该物质的摩尔质量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z形成的化合物不止一种 | |
| B. | X的氢化物比Y的氢化物稳定 | |
| C. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| D. | Y与Z或W形成的化合物中只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.4gNaHCO3晶体中含有0.1NA个CO32- | |
| B. | 常温常压下,32g臭氧所含的氧原子数为2NA | |
| C. | 0.1molFe与过量硝酸反应,转移电子数为0.2NA | |
| D. | 1molCH4与1molCl2在光照下反应,生成CH3Cl的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
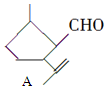 ,下列检验A中官能团的试剂和顺序正确的是( )
,下列检验A中官能团的试剂和顺序正确的是( )| A. | 先加溴水,再加KMnO4酸性溶液 | |
| B. | 先加入足量的新制Cu(OH)2悬浊液,微热,酸化后再加溴水 | |
| C. | 先加银氨溶液,微热,再加溴水 | |
| D. | 先加KMnO4酸性溶液,再加银氨溶液,微热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
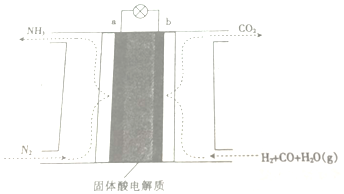
| A. | 放电时,b极表面H2与CO均被氧化 | |
| B. | 该电池工作时,H+由b极区迁移至a极区 | |
| C. | a极的电极反应为N2+6H++6e-=2NH3 | |
| D. | 工作一段时间后b极附近的PH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同 | |
| B. | 铜导线替换盐桥,原电池仍继续工作 | |
| C. | 开始时,银片上发生的反应是Ag-e-═Ag+ | |
| D. | 电子通过盐桥从乙池流向甲池 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com