
”¾ĢāÄæ”æ¢ń£®Ź®ĒāŻĮŹĒ¾ßÓŠøß“¢ĒāĆܶȵÄĒāÄÜŌŲĢ壬¾Ąś”°Ź®ĒāŻĮ£ØC10H18£©”śĖÄĒāŻĮ£ØC10H12£©”śŻĮ£ØC10H8£©”±µÄĶŃĒā¹ż³ĢŹĶ·ÅĒāĘų”£ŅŃÖŖ£ŗ
C10H18(l)![]() C10H12(l)£«3H2(g) ”÷H1
C10H12(l)£«3H2(g) ”÷H1
C10H12(l)![]() C10H8(l)£«2H2(g) ”÷H2
C10H8(l)£«2H2(g) ”÷H2
”÷H1£¾”÷H2£¾0£»C10H18”śC10H12µÄ»ī»ÆÄÜĪŖEa1£¬C10H12”śC10H8µÄ»ī»ÆÄÜĪŖEa2£¬Ź®ĒāŻĮµÄ³£Ń¹·ŠµćĪŖ192”ę£»ŌŚ192”ę£¬ŅŗĢ¬Ź®ĒāŻĮµÄĶŃĒā·“Ó¦µÄĘ½ŗā×Ŗ»ÆĀŹŌ¼ĪŖ9£„”£Ēė»Ų“š£ŗ
£Ø1£©ÓŠĄūÓŚĢįøßÉĻŹö·“Ó¦Ę½ŗā×Ŗ»ÆĀŹµÄĢõ¼žŹĒ_________”£
A£®øßĪĀøßŃ¹ B£®µĶĪĀµĶŃ¹ C£®øßĪĀµĶŃ¹ D£®µĶĪĀøßŃ¹
£Ø2£©ŃŠ¾æ±ķĆ÷£¬½«ŹŹĮæµÄŹ®ŻĮÄĪÖĆÓŚŗćČŻĆܱշ“Ó¦Ę÷ÖŠ£¬ÉżøßĪĀ¶Č“ųĄ“øßŃ¹£¬øĆĢõ¼žĻĀŅ²æÉĻŌÖųŹĶĒā£¬ĄķÓÉŹĒ______________________________________________________”£
£Ø3£©ĪĀ¶Č335”ę£¬ŌŚŗćČŻĆܱշ“Ó¦Ę÷ÖŠ½ųŠŠøßŃ¹ŅŗĢ¬Ź®ĒāŻĮ£Ø1.00 mol£©“ß»ÆĶŃĒāŹµŃ飬²āµĆC10H12ŗĶC10H8µÄ²śĀŹx1ŗĶx2£ØŅŌĪļÖŹµÄĮæ·ÖŹż¼Ę£©Ėꏱ¼ä±ä»Æ¹ŲĻµ£¬ČēĶ¼1ĖłŹ¾”£
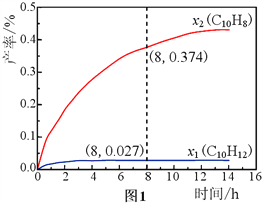

¢ŁŌŚ8 hŹ±£¬·“Ó¦ĢåĻµÄŚĒāĘųµÄĮæĪŖ__________mol£ØŗöĀŌĘäĖūø±·“Ó¦£©”£
¢Śx1ĻŌÖųµĶÓŚx2µÄŌŅņŹĒ________________________________________”£
¢ŪŌŚĶ¼2ÖŠ»ęÖĘ”°C10H18”śC10H12”śC10H8”±µÄ”°ÄÜĮ攫·“Ó¦¹ż³Ģ”±Ź¾ŅāĶ¼”£
¢ņ£®æĘѧ¼Ņ·¢ĻÖ£¬ŅŌH2OŗĶN2ĪŖŌĮĻ£¬ČŪČŚNaOH£KOHĪŖµē½āÖŹ£¬ÄÉĆ×Fe2O3×÷“߻ƼĮ£¬ŌŚ250”ęŗĶ³£Ń¹ĻĀæÉŹµĻÖµē»ÆѧŗĻ³É°±”£Ņõ¼«Ēų·¢ÉśµÄ±ä»ÆæÉŹÓĪŖ°“Į½²½½ųŠŠ£¬Ēė²¹³äĶźÕū”£
£Ø4£©µē¼«·“Ó¦Ź½£ŗ________________________________ŗĶ2Fe£«3H2O£«N2£½Fe2O3£«2NH3”£
”¾“š°ø”æ C ·“Ó¦ĪüČČ£¬ĪĀ¶ČÉżøߣ¬Ę½ŗāÕżĻņŅĘ¶Æ”£Óė“ĖĶ¬Ź±£¬ĪĀ¶ČÉżøßµ¼ÖĀŹ®ĒāŻĮĘų»Æ£¬ÅضČŌö“ó£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬Éś³ÉĒāĘųĮæĻŌÖųŌö¼Ó ¢Ł1.951£»¢Ś·“Ó¦2µÄ»ī»ÆÄܱȷ“Ó¦1Š”£¬ĻąĶ¬ĪĀ¶ČĻĀ·“Ó¦2øüæģ£¬ĖłŅŌĻąĶ¬Ź±¼äÄŚ£¬Éś³ÉµÄĖÄĒāŻĮ“ó²æ·Ö¶¼×Ŗ»ÆĪŖŻĮ£¬¹Źx1ĻŌÖųµĶÓŚx2.  Fe2O3+6e-+3H2O=2Fe+6OH
Fe2O3+6e-+3H2O=2Fe+6OH
”¾½āĪö”æ¢ń£®(1)C10H18(l)![]() C10H12(l)£«3H2(g) ”÷H1£¬C10H12(l)
C10H12(l)£«3H2(g) ”÷H1£¬C10H12(l)![]() C10H8(l)£«2H2(g) ”÷H2£¬”÷H1£¾”÷H2£¾0£»¾łĪŖĪüČČ·“Ó¦£¬ĒŅ¶¼ŹōÓŚĘųĢåµÄĪļÖŹµÄĮæŌö“óµÄ·“Ó¦”£
C10H8(l)£«2H2(g) ”÷H2£¬”÷H1£¾”÷H2£¾0£»¾łĪŖĪüČČ·“Ó¦£¬ĒŅ¶¼ŹōÓŚĘųĢåµÄĪļÖŹµÄĮæŌö“óµÄ·“Ó¦”£
A£®ÉżøßĪĀ¶Č£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬Ę½ŗā×Ŗ»ÆĀŹŌö“󣬵«Ōö“óŃ¹Ēæ£¬Ę½ŗāÄęĻņŅĘ¶Æ£¬Ę½ŗā×Ŗ»ÆĀŹ¼õŠ”£¬¹ŹA“ķĪó£»B£®½µµĶĪĀ¶Č£¬Ę½ŗāÄęĻņŅĘ¶Æ£¬Ę½ŗā×Ŗ»ÆĀŹ¼õŠ”£¬¹ŹB“ķĪó£»C£®ÉżøßĪĀ¶Č£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬Ę½ŗā×Ŗ»ÆĀŹŌö“󣬼õŠ”Ń¹Ēæ£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬Ę½ŗā×Ŗ»ÆĀŹŌö“󣬹ŹCÕżČ·£»D£®½µµĶĪĀ¶Č£¬Ę½ŗāÄęĻņŅĘ¶Æ£¬Ę½ŗā×Ŗ»ÆĀŹ¼õŠ”£¬¹ŹD“ķĪó£»¹ŹŃ”C£»
(2)×Ü·“Ó¦ĪŖøĆ·“Ó¦ĪŖĪüČČ·“Ó¦£¬ÉżøßĪĀ¶Č£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬Ę½ŗā×Ŗ»ÆĀŹŌö“ó£¬Ę½ŗā³£ŹżŌö“󣬵±ĪĀ¶Č“ļµ½192”ꏱ£¬Ź®ĒāŻĮĘų»Æ£¬ÅضČŌö“ó£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬Éś³ÉĒāĘųĮæĻŌÖųŌö¼Ó£¬¹Ź“š°øĪŖ£ŗ·“Ó¦ĪüČČ£¬ĪĀ¶ČÉżøߣ¬Ę½ŗāÕżĻņŅĘ¶Æ”£Óė“ĖĶ¬Ź±£¬ĪĀ¶ČÉżøßµ¼ÖĀŹ®ĒāŻĮĘų»Æ£¬ÅضČŌö“ó£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬Éś³ÉĒāĘųĮæĻŌÖųŌö¼Ó£»
(3)¢ŁĪĀ¶Č335”ę£¬ŌŚ8 hŹ±£¬Ź®ĒāŻĮĪŖ1.00 mol£¬²āµĆC10H12ŗĶC10H8µÄ²śĀŹx1=0.027£¬x2=0.374£¬¼“Éś³ÉC10H12ŗĶC10H8µÄĪļÖŹµÄĮæ·Ö±šĪŖ0.027mol£¬0.374mol£¬Éč·“Ó¦µÄC10H18µÄĪļÖŹµÄĮæĪŖa£¬·“Ó¦C10H12µÄĪļÖŹµÄĮæĪŖb£¬øł¾Ż·“Ó¦
C10H18(l)![]() C10H12(l)£«3H2(g)
C10H12(l)£«3H2(g)
1 1 3
a a 3a
C10H12(l)![]() C10H8(l)£«2H2(g)£¬
C10H8(l)£«2H2(g)£¬
1 1 2
b b 2b
Ōņa-b=0.027£¬b=0.374£¬Ōņa=0.401£¬Ņņ“ĖÉś³ÉµÄĒāĘųµÄĪļÖŹµÄĮæ·ÖŹżĪŖ3a+2b=3”Į0.401+2”Į0.374=1.951£¬ŌņĒāĘųµÄĮæĪŖ1.951mol£¬¹Ź“š°øĪŖ£ŗ1.951£»
¢Ś·“Ó¦2µÄ»ī»ÆÄܱȷ“Ó¦1Š”£¬ĻąĶ¬ĪĀ¶ČĻĀ·“Ó¦2øüæģ£¬ĖłŅŌĻąĶ¬Ź±¼äÄŚ£¬Éś³ÉµÄĖÄĒāŻĮ“ó²æ·Ö¶¼×Ŗ»ÆĪŖŻĮ£¬¹Źx1ĻŌÖųµĶÓŚx2£¬¹Ź“š°øĪŖ£ŗ·“Ó¦2µÄ»ī»ÆÄܱȷ“Ó¦1Š”£¬ĻąĶ¬ĪĀ¶ČĻĀ·“Ó¦2øüæģ£¬ĖłŅŌĻąĶ¬Ź±¼äÄŚ£¬Éś³ÉµÄĖÄĒāŻĮ“ó²æ·Ö¶¼×Ŗ»ÆĪŖŻĮ£¬¹Źx1ĻŌÖųµĶÓŚx2£»
¢ŪC10H18(l)![]() C10H12(l)£«3H2(g) ”÷H1£¬C10H12(l)
C10H12(l)£«3H2(g) ”÷H1£¬C10H12(l)![]() C10H8(l)£«2H2(g) ”÷H2£¬”÷H1£¾”÷H2£¾0£»ÉĻŹö·“Ó¦¾łĪŖĪüČČ·“Ó¦£¬Éś³ÉĪļµÄ×ÜÄÜĮæ“óÓŚ·“Ó¦Īļ£¬”°C10H18”śC10H12”śC10H8”±µÄ”°ÄÜĮ攫·“Ó¦¹ż³Ģ”± Ź¾ŅāĶ¼ĪŖ
C10H8(l)£«2H2(g) ”÷H2£¬”÷H1£¾”÷H2£¾0£»ÉĻŹö·“Ó¦¾łĪŖĪüČČ·“Ó¦£¬Éś³ÉĪļµÄ×ÜÄÜĮæ“óÓŚ·“Ó¦Īļ£¬”°C10H18”śC10H12”śC10H8”±µÄ”°ÄÜĮ攫·“Ó¦¹ż³Ģ”± Ź¾ŅāĶ¼ĪŖ £¬¹Ź“š°øĪŖ£ŗ
£¬¹Ź“š°øĪŖ£ŗ £»
£»
¢ņ£®(4)ŅŌH2OŗĶN2ĪŖŌĮĻ£¬ČŪČŚNaOH£KOHĪŖµē½āÖŹ£¬ÄÉĆ×Fe2O3×÷“߻ƼĮ£¬ŌŚ250”ęŗĶ³£Ń¹ĻĀæÉŹµĻÖµē»ÆѧŗĻ³É°±”£Ņõ¼«Ēų·¢Éś»¹Ō·“Ó¦£¬¾ŻĘäÖŠŅ»øö·“Ó¦2Fe£«3H2O£«N2£½Fe2O3£«2NH3£¬æÉÖŖ£¬Fe2O3×÷“߻ƼĮ£¬Ź×ĻČ×Ŗ»ÆĪŖĢś£¬Ņņ“Ėµē¼«·“Ó¦Ź½ĪŖFe2O3+6e-+3H2O=2Fe+6OH-£¬¹Ź“š°øĪŖ£ŗFe2O3+6e-+3H2O=2Fe+6OH-”£


 ×ß½ųĪÄŃŌĪÄĻµĮŠ“š°ø
×ß½ųĪÄŃŌĪÄĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»¶ØĮæ»ģŗĻĘųĢåŌŚĆܱÕČŻĘ÷ÖŠ·¢ÉśČēĻĀ·“Ó¦:mA(g)+nB(g) ![]() pC(g),“ļµ½Ę½ŗāŗó£¬ĪĀ¶Č²»±ä£¬½«ĘųĢåĢå»żŃ¹Ėõµ½1/2£¬µ±“ļµ½Ę½ŗāŹ±CµÄÅضČĪŖŌĄ“µÄ1.9±¶£¬ŌņĻĀĮŠŠšŹöÕżČ·µÄŹĒ( )
pC(g),“ļµ½Ę½ŗāŗó£¬ĪĀ¶Č²»±ä£¬½«ĘųĢåĢå»żŃ¹Ėõµ½1/2£¬µ±“ļµ½Ę½ŗāŹ±CµÄÅضČĪŖŌĄ“µÄ1.9±¶£¬ŌņĻĀĮŠŠšŹöÕżČ·µÄŹĒ( )
A. m+n£¾p B. AµÄ×Ŗ»ÆĀŹŌö¼Ó
C. Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ D. CµÄĢå»ż·ÖŹżŌö“ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĶ¼ĻóŹĒ±ķŹ¾ĢśøśŅ»¶ØĮæĻõĖį·“Ó¦Ź±£¬ĢśŗĶĻõĖįĢśÖ®¼äĪļÖŹµÄĮæ£Ømol£©µÄ¹ŲĻµ£¬ĘäÖŠÕżČ·µÄŹĒ£Ø £©
A.
B.
C.
D.
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ŌÓŚæÉÄę·“Ó¦A£Øg£©+ 2B(g)![]() 2C(g)(Õż·“Ó¦ĪüČČ)£¬ĻĀĮŠĶ¼ĻóÖŠÕżČ·µÄŹĒ£Ø £©
2C(g)(Õż·“Ó¦ĪüČČ)£¬ĻĀĮŠĶ¼ĻóÖŠÕżČ·µÄŹĒ£Ø £©
A. 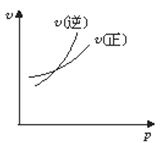 B.
B. 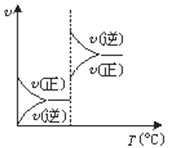
C.  D.
D. 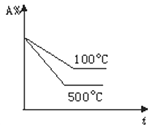
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ25 ”ꏱ£¬ŌŚ”°H2A”ŖHA-”ŖA2-”±µÄĖ®ČÜŅŗĢåĻµÖŠ£¬H2A”¢HA-ŗĶA2- ČżÕßÖŠø÷×ŌĖłÕ¼µÄĪļÖŹµÄĮæ·ÖŹż£Ø¦Į£©ĖęČÜŅŗpH±ä»ÆµÄ¹ŲĻµČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
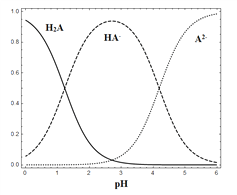
A. ŌŚŗ¬H2A”¢HA-ŗĶA2- µÄČÜŅŗÖŠ£¬¼ÓČėÉŁĮæNaOH¹ĢĢ壬¦Į£ØHA-£©Ņ»¶ØŌö“ó
B. ½«µČĪļÖŹµÄĮæµÄNaHAŗĶNa2A»ģŗĻĪļČÜÓŚĖ®£¬ĖłµĆµÄČÜŅŗÖŠ¦Į£ØHA-£©=¦Į£ØA2-£©
C. NaHAČÜŅŗÖŠ£¬HA-µÄĖ®½āÄÜĮ¦Š”ÓŚHA-µÄµēĄėÄÜĮ¦
D. ŌŚŗ¬H2A”¢HA-ŗĶA2-µÄČÜŅŗÖŠ£¬Čōc(H2A)+2c(A2-)+c(OH-)=c(H+)£¬Ōņ¦Į£ØH2A£©ŗĶ¦Į£ØHA-£©Ņ»¶ØĻąµČ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĆęµÄ¼Ūµē×ÓÅŲ¼ÖŠ£¬µŚŅ»µēĄėÄÜ×īŠ”µÄŌ×ÓæÉÄÜŹĒ£Ø £©
A.ns2np3B.ns2np5C.ns2np4D.ns2np6
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠø÷×éĪļÖŹÖŠ£¬Ö»ŅŖ×ÜÖŹĮæŅ»¶Ø£¬²»ĀŪŅŌŗĪÖֱȥż»ģŗĻ£¬ĶźČ«Č¼ÉÕ£¬Éś³ÉµÄ¶žŃõ»ÆĢ¼ŗĶĖ®µÄÖŹĮæŅ²×ÜŹĒ¶ØÖµµÄ(””””)
A. ¼×ĶéŗĶŅŅĶé B. ŅŅĶéŗĶŅŅĻ©
C. ±ūĶéŗĶŅŅĻ© D. ŅŅĻ©ŗĶ±ūĻ©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚĪĀ¶Č²»±äµÄĢõ¼žĻĀ£¬ŌŚŗćČŻµÄČŻĘ÷ÖŠ½ųŠŠĻĀĮŠ·“Ó¦£ŗN2O4£Øg£©ØT2NO2£Øg£©£¬ČōN2O4µÄÅضČÓÉ0.1molL©1½µµ½0.07molL©1ŠčŅŖ15s£¬ÄĒĆ“N2O4µÄÅضČÓÉ0.07molL©1½µµ½0.05molL©1ĖłŠčµÄ·“Ó¦Ź±¼ä£Ø £©
A.µČÓŚ5s
B.µČÓŚ10s
C.Š”ÓŚ10s
D.“óÓŚ10s
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ50ml0.50molL©1ŃĪĖįÓė50mL0.55molL©1NaOHČÜŅŗŌŚČēĶ¼ĖłŹ¾µÄ×°ÖĆÖŠ½ųŠŠÖŠŗĶ·“Ó¦£®Ķعż²ā¶Ø·“Ó¦¹ż³Ģ ÖŠ·Å³öµÄČČĮææɼĘĖćÖŠŗĶČČ£®»Ų“šĻĀĮŠĪŹĢā£ŗ 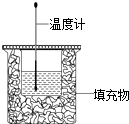
£Ø1£©“ÓŹµŃé×°ÖĆÉĻæ“£¬Ķ¼ÖŠČ±ÉŁµÄŅĒĘ÷ŹĒ £®
£Ø2£©ŹµŃéÖŠČōÓĆ70mL0.50molL©1ŃĪĖįøś70mL0.55molL©1NaOHČÜŅŗ½ųŠŠ·“Ó¦£¬ÓėÉĻŹöŹµŃéĻą±Č£¬Ėł·Å³öµÄČČĮæ£ØĢī”°ĻąµČ”±»ņ”°²»ĻąµČ”±£©£¬ĖłĒóÖŠŗĶČČ£ØĢī”°ĻąµČ”±»ņ”°²»ĻąµČ”±£©£®
£Ø3£©ÓĆ50ml0.25molL©1H2SO4“śĢęŃĪĖį£¬ÓĆ50mL0.275molL©1Ba£ØOH£©2“śĢę NaOHČÜŅŗ½ųŠŠÉĻŹöŹµŃ飬²āµĆµÄÖŠŗĶČČµÄ¾ų¶ŌÖµ»į£ØĢī”°Ę«“ó”±”°Ę«Š””±»ņ”°ĪŽÓ°Ļģ”±£©£®
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com