
��ͼ��ʾ373Kʱ����ӦA(g) ![]() 2B(g) ��ǰ110s�ڵķ�Ӧ���̣����÷�Ӧ�������ٽ��У�
2B(g) ��ǰ110s�ڵķ�Ӧ���̣����÷�Ӧ�������ٽ��У�
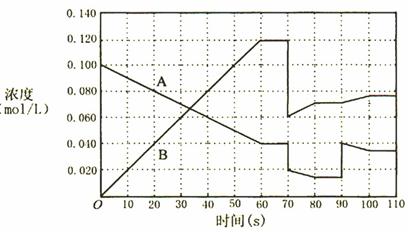
(1)д���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK=_____________________
T(K) | 273 | 323 | 373 |
K | 0.0005 | 0.022 | 0.36 |
(2)A(g) ![]() 2B(g)�ڲ�ͬ�¶��µ�Kֵ���ϱ�����÷�Ӧ���淴ӦΪ_________��Ӧ(����ȡ������ȡ�)���ӿ�ʼ����һ�δﵽƽ������У���B��ʾ��Ӧƽ������Ϊ_______��
2B(g)�ڲ�ͬ�¶��µ�Kֵ���ϱ�����÷�Ӧ���淴ӦΪ_________��Ӧ(����ȡ������ȡ�)���ӿ�ʼ����һ�δﵽƽ������У���B��ʾ��Ӧƽ������Ϊ_______��
(3)�¶����ߣ�B��ת����_____________�����������С�������䡰����ͬ����B�ķ�Ӧ����___________��
(4)373Kʱ����A�������һ�ܱ������ڽ��з�Ӧ������ͼ�жϣ�90~100sʱ�����߱仯��ԭ���ǣ����ֱ���ʽ��____________________________________����Ӧ������70sʱ���ı������������___________�����ţ���
A . ���븺���� B. ����������� C. �����¶� D .����A��Ũ��
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Ӧ ![]()
![]()
![]() �ֱ���673K��373Kʱ���У���C�����������ʱ��Ĺ�ϵ��������ͼ��ʾ����������ȷ��ʾ�˷�Ӧ��ͼ���ǣ� ����
�ֱ���673K��373Kʱ���У���C�����������ʱ��Ĺ�ϵ��������ͼ��ʾ����������ȷ��ʾ�˷�Ӧ��ͼ���ǣ� ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ������ʡ�������С������ѧ�߶���ѧ�����п��Ի�ѧ�Ծ������������������� ���ͣ������
��1����3�֣�һ���¶��£���4L�ܱ������м���1molHI��g��������2HI��g�� H2��g��+I2��g����H2���ʵ�����ʱ��ı仯��ͼ��ʾ��0~2min�ڵ�ƽ����Ӧ����v��HI��= mol/(L��min)��
H2��g��+I2��g����H2���ʵ�����ʱ��ı仯��ͼ��ʾ��0~2min�ڵ�ƽ����Ӧ����v��HI��= mol/(L��min)��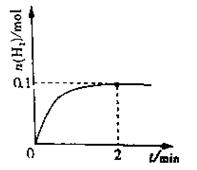
��2����3�֣���ij�¶��£���ӦSO2(g)+ 1/2O2(g)  SO3 (g) ��ƽ�ⳣ��K1=50����ͬһ�¶��£���Ӧ2SO3(g)
SO3 (g) ��ƽ�ⳣ��K1=50����ͬһ�¶��£���Ӧ2SO3(g)  2SO2(g) + O2(g)��ƽ�ⳣ��K2��ֵΪ ��
2SO2(g) + O2(g)��ƽ�ⳣ��K2��ֵΪ ��
��3����3�֣�ij�¶��£���һ��2 L���ܱ������У�����4 mol A��2 mol B�������·�Ӧ��3A(g)��2B(g) 4C(��)��2D(��)����Ӧһ��ʱ���ﵽƽ�⣬�������1.6 mol C���ҷ�Ӧ��ǰ��ѹǿ֮��Ϊ5��4(��ͬ���¶��²���)����÷�Ӧ�Ļ�ѧƽ�ⳣ����
4C(��)��2D(��)����Ӧһ��ʱ���ﵽƽ�⣬�������1.6 mol C���ҷ�Ӧ��ǰ��ѹǿ֮��Ϊ5��4(��ͬ���¶��²���)����÷�Ӧ�Ļ�ѧƽ�ⳣ����
K= �����г���ʽ���������ݼ��ɣ�
��4����7�֣���ͼ��ʾ373Kʱ����ӦA(g)  2B(g)��ǰ110s�ڵķ�Ӧ���̡�
2B(g)��ǰ110s�ڵķ�Ӧ���̡�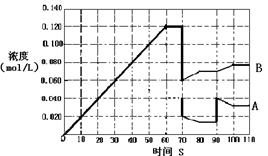
��373Kʱ��Ӧ���е�70sʱ���ı������������________����Ӧ���е�90sʱ���ı������������_____��
| A��������� | B������������� | C�������¶� | D������A��Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014������ʡ�߶���ѧ�����п��Ի�ѧ�Ծ����������������棩 ���ͣ������
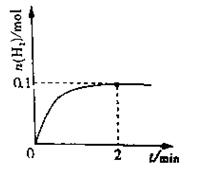
��1����3�֣�һ���¶��£���4L�ܱ������м���1molHI��g��������2HI��g�� H2��g��+I2��g����H2���ʵ�����ʱ��ı仯��ͼ��ʾ��0~2min�ڵ�ƽ����Ӧ����v��HI��= mol/(L��min)��
H2��g��+I2��g����H2���ʵ�����ʱ��ı仯��ͼ��ʾ��0~2min�ڵ�ƽ����Ӧ����v��HI��= mol/(L��min)��
��2����3�֣���ij�¶��£���ӦSO2(g)+ 1/2O2(g)  SO3 (g) ��ƽ�ⳣ��K1=50����ͬһ�¶��£���Ӧ2SO3(g)
SO3 (g) ��ƽ�ⳣ��K1=50����ͬһ�¶��£���Ӧ2SO3(g)  2SO2(g) + O2(g)��ƽ�ⳣ��K2��ֵΪ ��
2SO2(g) + O2(g)��ƽ�ⳣ��K2��ֵΪ ��
��3����3�֣�ij�¶��£���һ��2 L���ܱ������У�����4 mol A��2 mol B�������·�Ӧ��3A(g)��2B(g) 4C(��)��2D(��)����Ӧһ��ʱ���ﵽƽ�⣬�������1.6 mol C���ҷ�Ӧ��ǰ��ѹǿ֮��Ϊ5��4(��ͬ���¶��²���)����÷�Ӧ�Ļ�ѧƽ�ⳣ����
4C(��)��2D(��)����Ӧһ��ʱ���ﵽƽ�⣬�������1.6 mol C���ҷ�Ӧ��ǰ��ѹǿ֮��Ϊ5��4(��ͬ���¶��²���)����÷�Ӧ�Ļ�ѧƽ�ⳣ����
K= �����г���ʽ���������ݼ��ɣ�
��4����7�֣���ͼ��ʾ373Kʱ����ӦA(g)  2B(g)��ǰ110s�ڵķ�Ӧ���̡�
2B(g)��ǰ110s�ڵķ�Ӧ���̡�
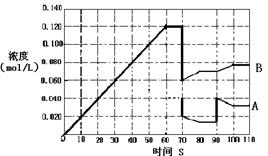
��373Kʱ��Ӧ���е�70sʱ���ı������������________����Ӧ���е�90sʱ���ı������������_____��
A��������� B������������� C�������¶� D������A��Ũ��
������ͼ�л�����Ӧ��A��0��70��ʱ��Ũ�ȱ仯���ߡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
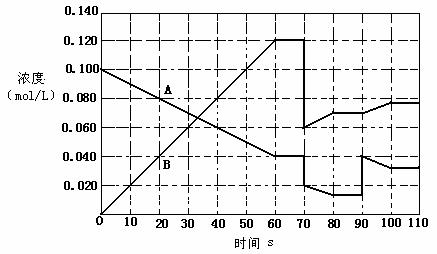
��ͼ��ʾ373Kʱ����ӦA(g) ![]() 2B(g)��ǰ110s�ڵķ�Ӧ���̣����÷�Ӧ�������ٽ��еģ�
2B(g)��ǰ110s�ڵķ�Ӧ���̣����÷�Ӧ�������ٽ��еģ�
T(K) |
K |
�¶� | 273K | 323K | 373K |
ƽ�ⳣ�� | 0.005 | 0.022 | 0.36 |
��1���˷�Ӧ��ƽ�ⳣ���ı���ʽK=_____________��
��2��A(g)�� ![]() �� 2B(g)�ڲ�ͬ�¶��µ�Kֵ���ϱ�����÷�Ӧ���淴ӦΪ__________������ȡ����ȡ�����Ӧ��
�� 2B(g)�ڲ�ͬ�¶��µ�Kֵ���ϱ�����÷�Ӧ���淴ӦΪ__________������ȡ����ȡ�����Ӧ��
��3�������¶ȣ�B��ת����__________�����������С�����䡱����ͬ����B�ķ�Ӧ����_______________��
��4��373Kʱ����һ�ܱ������У���A���������з�Ӧ����ͼ�жϣ�80-90s�ڷ�Ӧ���ĸ������ƶ�___________(����������ҡ��������ƶ���)��90sʱ���߱仯��ԭ���ǣ������ֱ��_________________________,��Ӧ���е�70sʱ���ı�����������ǣ����ţ�_____________________
A������������� B��������������� C�������¶ȡ� D������A��Ũ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com