
【题目】下列解释事实的离子方程式中,不正确的是![]()
A.铝片放入NaOH溶液中有气体产生:![]()
B.泡沫灭火器灭火的原理:![]()
C.氨水吸收少量![]() 防止污染空气:
防止污染空气:![]()
D.“84”消毒液中滴少量白醋可增强漂白性:![]()
【答案】C
【解析】
A.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
B.泡沫灭火器的灭火原理:铝离子与碳酸根离子发生双水解反应;
C.氨水与少量的二氧化硫反应生成亚硫酸铵;
D.醋酸的酸性大于次氯酸,醋酸能与次氯酸盐反应生成次氯酸。
![]() 片置于NaOH溶液中,产生气体,反应的离子方程式为:
片置于NaOH溶液中,产生气体,反应的离子方程式为:![]() ,故A正确;
,故A正确;
B.泡沫灭火器的灭火原理:铝离子与碳酸氢根离子发生双水解反应,离子方程式为:![]() ,故B正确;
,故B正确;
C.氨水与少量的二氧化硫反应生成亚硫酸铵,没有亚硫酸氢根离子生成,正确的离子方程式为:![]() ,故C错误;
,故C错误;
D.醋酸的酸性大于次氯酸,醋酸能与次氯酸盐反应生成次氯酸,则“84”消毒液中滴少量白醋可增强漂白性:![]() ,故D正确;
,故D正确;
故选:C。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】A、B是中学化学常见的化合物,它们各由两种元素组成;乙为元素R组成的单质,它们之间存在如图所示关系.根据要求回答问题:
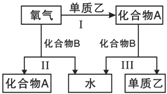
![]() 如图三个反应中,属于氧化还原反应的有______个.
如图三个反应中,属于氧化还原反应的有______个.
![]() 若元素R与氧同主族,下列事实能说明R与氧的非金属性相对强弱的有______.
若元素R与氧同主族,下列事实能说明R与氧的非金属性相对强弱的有______.
A.还原性:![]() B.酸性:
B.酸性:![]()
C.稳定性:![]() C.沸点:
C.沸点:![]()
![]() 若化合物B常温下为气体,其水溶液呈碱性
若化合物B常温下为气体,其水溶液呈碱性![]() 答题必须用具体物质表示
答题必须用具体物质表示![]() .
.
![]() 化合物B的电子式为______;其水溶液呈碱性的原因是______
化合物B的电子式为______;其水溶液呈碱性的原因是______![]() 用离子方程式表示
用离子方程式表示![]() .
.
![]() 化合物B可与
化合物B可与![]() 组成燃料电池
组成燃料电池![]() 氢氧化钾溶液为电解质溶液
氢氧化钾溶液为电解质溶液![]() ,其反应产物与反应Ⅲ相同.写出该电池负极的电极反应式______.
,其反应产物与反应Ⅲ相同.写出该电池负极的电极反应式______.
![]() 当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为
当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为![]() 和
和![]() ,则反应Ⅰ的热化学方程式为______
,则反应Ⅰ的热化学方程式为______![]() 注:反应条件相同、所有物质均为气体
注:反应条件相同、所有物质均为气体![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,如下图是从该矿渣中回收NiSO4的工艺路线:
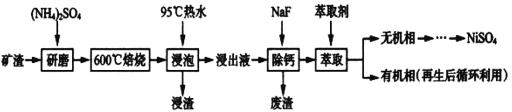
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4,NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。锡(Sn)位于第五周期第IVA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是_______________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为_________________________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有___________________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将:Fe3+还原为Fe2+,所需SnC12的物质的量不少于Fe3+物质的量的_____倍:除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为_________________________________________。
(4)“浸出液”中c(Ca2+)=1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-)=___mol· L-1。[已知KSP(CaF2)=4.0×10-11]
(5)已知正十二烷可用作该工艺的萃取剂。用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷。已知电解总反应为:2C6H13COONa+2CH3OH![]() C12H26+2CO2↑+H2↑+2CH3ONa,则阳极的电极反应式为______________________________________
C12H26+2CO2↑+H2↑+2CH3ONa,则阳极的电极反应式为______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2LSO3含有的氧原子个数为1.5NA
B.100g34%的双氧水中含有H—O键的数目为2NA
C.16.25gFeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
D.16.8gFe粉与足量水蒸气完全反应,转移的电子数目为0.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验事实的方程式不正确的是( )
A.用Na2S处理含Hg2+的废水:Hg2++S2-=HgS↓
B.向沸水中滴加饱和氯化铁溶液得到红褐色液体:FeCl3+3H2O=Fe(OH)3(胶体)+3HCl
C.向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀:3Mg(OH)2+2FeCl3=2Fe(OH)3+3MgCl2
D.Na2O2加入H218O中:2Na2O2+2H2l8O=4Na++4OH-+18O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸式盐NaHY的水溶液显碱性,下列叙述不正确的是
A.H2Y的电离方程式:H2Y![]() 2H+ + Y2-
2H+ + Y2-
B.HY- 水解的离子方程式:HY- + H2O![]() H2Y + OH-
H2Y + OH-
C.该酸式盐溶液中离子浓度大小关系:c(Na+) > c(HY-)>c(OH-) >c(H+)
D.该酸式盐溶液中微粒浓度关系:c(H+)+c(H2Y) = c(OH-)+c(Y2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将28.8g铜与150mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为___L,NO2的体积为___L;
(2)待产生的气体全部释放,向溶液中加入200mL5mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回收和利用CO2是环境科学家研究的热点,是减轻温室效应危害的重要途径。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图所示。其总反应的化学方程式为_____________。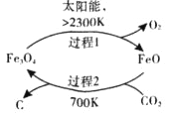
(2)CO2经过催化氢化合成低碳烯烃。合成乙烯的反应为
2CO2(g)+6H2(g)==CH2=CH2(g)+4H2O(g) △H=akJ/mol
已知:
键 | H-H | C=O | C=C | O-H | C-H |
键能/kJ/mol | 436.0 | 745.0 | 615.0 | 462.8 | 413.4 |
则a=________。
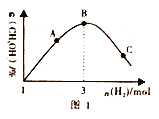
(3)T℃时。在恒容密闭容器中充入1molCO2和nmolH2,在一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0,混合气体中CH3OH 的体积分数与氢气的物质的量的关系如图所示。图1中A、B、C 三点对应的体系。CO的转化率最大的是____(填字母),判断理由是____________。
CH3OH(g)+H2O(g) △H<0,混合气体中CH3OH 的体积分数与氢气的物质的量的关系如图所示。图1中A、B、C 三点对应的体系。CO的转化率最大的是____(填字母),判断理由是____________。
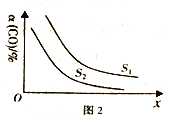
(4) 工业上也用合成气(H2和CO) 合成甲醇,反应为2H2(g)+CO(g)![]() CH3OH(g) △H<0,在10L的恒容密团容器中充入H2和CO的物质的量分别为2mol和1mol,测得CO的平衡转化率与温度、压强的关系如图2所示。
CH3OH(g) △H<0,在10L的恒容密团容器中充入H2和CO的物质的量分别为2mol和1mol,测得CO的平衡转化率与温度、压强的关系如图2所示。
①图2中S代表的物理量是_________。
②已知300℃时上述反应达到平衡时,CO 的平衡转化率为60% 若再向该平衡体系中再加入2molCO、2molH2、2molCH3OH 若保持温度和容器休积不变,则平衡会_____(填“正向移动”“逆向移动”或“不移动”)。
(5)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下图所示:

①阳极区产生CO2的原因是________(用离子方程式表示)。
②利用平衡移动原理,简述CO32-在阴极区再生的原因____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是( )
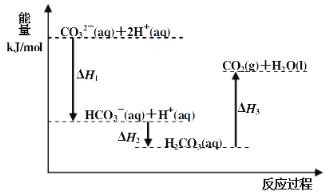
A.反应HCO3-(aq)+H+(aq)=CO2(g)+H2O(l) 为放热反应
B.CO32-(aq)+2H+(aq)=CO2(g)+H2O(l) H=(H1+H2+H3)
C.H1>H2 H2<H3
D.H2CO3(aq)=CO2(g)+H2O(l),若使用催化剂,则H3变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com