
【题目】已知铝土矿的主要成分是Al2O3,含有杂质SiO2(不溶于盐酸和水)、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:
请回答下列问题:
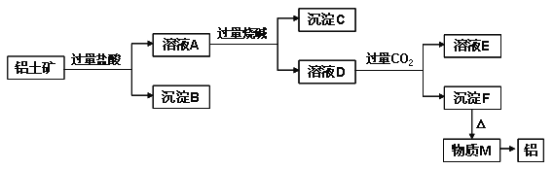
(1)溶液A转化为溶液D发生的离子方程式为________________________________。
(2)由物质M制取铝的化学方程式为________________________________________。
(3)溶液D中通入过量CO2生成沉淀F的离子方程式为________________________。
(4)沉淀C的成分是____________ ,逐滴向少量沉淀C中加入过量盐酸至沉淀全部溶解,此过程的实验现象为_______________________________________________。
【答案】 Al3++4OH-=AlO2-+2H2O 2Al2O3![]() 4Al + 3O2↑ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- Fe(OH)3 Mg(OH)2 沉淀全部溶解,溶液变为棕黄色
4Al + 3O2↑ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- Fe(OH)3 Mg(OH)2 沉淀全部溶解,溶液变为棕黄色
【解析】加入盐酸后二氧化硅不溶,沉淀B是二氧化硅,A中含有氯化铝、氯化镁、氯化铁以及过量的盐酸。加入过量的氢氧化钠后,生成氢氧化铁、氢氧化镁沉淀以及偏铝酸钠和氯化钠,通入过量的二氧化碳后偏铝酸钠转化为氢氧化铝沉淀,同时还有碳酸氢钠生成。氢氧化铝分解生成氧化铝和水,电解熔融的氧化铝得到金属铝。
(1)根据以上分析可知溶液A转化为溶液D发生的离子方程式为Al3++4OH-=AlO2-+2H2O。(2)根据以上分析可知由物质M制取铝的化学方程式为2Al2O3![]() 4Al + 3O2↑。(3)根据以上分析可知溶液D中通入过量CO2生成沉淀F的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。(4)根据以上分析可知沉淀C的成分是Fe(OH)3、Mg(OH)2,逐滴向少量沉淀C中加入过量盐酸至沉淀全部溶解,氢氧化铁转化为氯化铁,氢氧化镁转化为氯化镁,所以此过程的实验现象为沉淀全部溶解,溶液变为棕黄色。
4Al + 3O2↑。(3)根据以上分析可知溶液D中通入过量CO2生成沉淀F的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。(4)根据以上分析可知沉淀C的成分是Fe(OH)3、Mg(OH)2,逐滴向少量沉淀C中加入过量盐酸至沉淀全部溶解,氢氧化铁转化为氯化铁,氢氧化镁转化为氯化镁,所以此过程的实验现象为沉淀全部溶解,溶液变为棕黄色。


科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连.请回答以下问题: 
(1)若X,Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则 电解池中Y极上的电极反应式为 . 在X极附近观察到的现象是 .
(2)若X,Y都是惰性电极,a是CuSO4溶液,X电极上的电极反应式为 , 在X极附近观察到的现象是 .
(3)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是 , 电极反应式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲配制100mL 1.0molL﹣1Na2SO4溶液,正确的方法是( )
①将7.1g Na2SO4溶于50mL水中
②将32.2g Na2SO410H2O晶体溶于少量水中,然后再用水稀释至100mL
③将25mL4.0molL﹣1Na2SO4溶液溶于75mL水中
④将50mL2.0molL﹣1Na2SO4溶液加入到40mL水中,然后再用水稀释至100mL.
A.①②
B.①③
C.②③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在自然界中氢有三种同位素1H、2H、3H,氧也有三种同位素16O、17O、18O,若由上述元素的原子形成水分子,其中水分子的相对分子质量最大值是( )
A.18B.20C.22D.24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L.下列各组混合烃中不符合此条件的是( )
A.CH4与C2H4
B.C2H2与C3H6
C.C2H4与C3H4
D.CH4与C3H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO47H2O的工艺流程如下:(己知Cd的金属活动性介于Zn和Fe之间)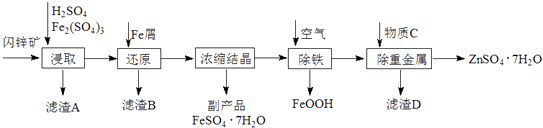
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 .
(2)浸取过程中Fe2(SO4)3的作用是 , 浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 .
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 . 该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 .
(4)置换法除重金属离子是Cd2+ , 所用物质C为 .
(5)硫酸锌的溶解度与温度之间的关系如下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为、、过滤、干燥.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某盐的混合物中含有0.2mol/L Na+、0.4mol/L Mg2+、0.4mol/L Clˉ,则SO42ˉ为( )
A.0.1mol/L
B.0.2mol/L
C.0.3mol/L
D.0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用含有少量氯化钙的氯化钠固体,配制100 mL 1mol·L-1的氯化钠溶液,设计了下面的操作方案。根据方案操作步骤回答下列问题:
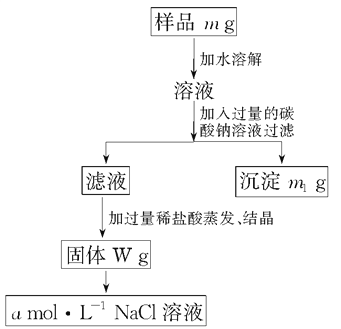
(1)称量粗盐样品m g,所用仪器名称为:_____________。
(2)过滤时,玻璃棒的作用是:__________________。
(3)蒸发操作时应将液体放在__________中加热,等加热至________时即停止加热。
(4)在样品的溶液中加入过量的Na2CO3溶液,作用是__________________,反应的化学方程式是______________________________________。
(5)在滤液中加入盐酸的作用是____________________________________,
反应的离子程式是_______________________________________。
(6)配制100 mL 1 mol·L-1的NaCl溶液时,应从W g固体中称取NaCl的质量为________,配制时应在________中进行定容。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com