
【题目】N、O、Na、Mg、S、Br是常见的六种元素.
(1)Br位于元素周期表第周期第族;Na和O形成1:1的化合物的电子式: . 该物质含有的化学键为: .
(2)用“>”或“<”填空:
稳定性 | 粒子半径 | 熔点 | 键的极性 |
NH3H2O | O2﹣Mg2+ | SO3 | H﹣O |
(3)已知多硫化钠一溴储能电池是一种二次电池,结构如图.电池总反应为:2Na2S3+2NaBr ![]() 3Na2S2+Br2①放电时Na+向极迁移(填“a或b,”).
3Na2S2+Br2①放电时Na+向极迁移(填“a或b,”).
②放电时负极的电极反应式为:
(4)已知N4为正四面体结构,N﹣N键能为167kJmol﹣1 , N≡N键能为942kJmol﹣1 . 写出N4(g)转化为N2(g)的热化学方程式 . 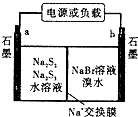
【答案】
(1)四;VIIA;![]() ;离子键和非极性键
;离子键和非极性键
(2)<;>;<;>
(3)b;3S22﹣﹣2e﹣=2S32﹣
(4)N4(g)=2N2(g)△H=﹣882kJ/mol
【解析】解:(1)主族元素原子电子层数与其周期数相等,最外层电子数与其族序数相等,Br原子核外有4个电子层、最外层电子数是7,所以位于第四周期第VIIA族;Na和O形成1:1的化合物是过氧化钠,其电子式为 ![]() ,过氧化钠中存在离子键和非极性键, 所以答案是:四;VIIA;
,过氧化钠中存在离子键和非极性键, 所以答案是:四;VIIA; ![]() ;离子键和非极性键;(2)元素的非金属性越强,其氢化物的稳定性越强,非金属性N<O,所以稳定性NH3<H2O;
;离子键和非极性键;(2)元素的非金属性越强,其氢化物的稳定性越强,非金属性N<O,所以稳定性NH3<H2O;
电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径O2﹣>Mg2+;
离子晶体熔沸点大于分子晶体,三氧化硫是分子晶体、过氧化钠是离子晶体,所以熔点SO3<Na2O2;
非金属性元素非金属性越强,其吸引电子能力越强,则键的极性越强,非金属性O>N,则键的极性H﹣O>H﹣N;
所以答案是:<;>;<;>;(3)①放电时,溴电子发生还原反应,则a是负极、b是正极,电解质溶液中阳离子向正极移动,所以向b电极移动,所以答案是:b;
②放电时,负极上失电子发生氧化反应,电极反应式为3S22﹣﹣2e﹣=2S32﹣ , 所以答案是:3S22﹣﹣2e﹣=2S32﹣;(4)该反应焓变=反应物键能﹣生成物键能=6×167kJ/mol﹣2×942kJ/mol=﹣882kJ/mol,则该反应热化学方程式为N4(g)=2N2(g)△H=﹣882 kJ/mol,所以答案是:N4(g)=2N2(g)△H=﹣882 kJ/mol.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1mol/L,加入等体积0.3mol/L的BaCl2溶液恰好使SO42﹣完全沉淀,则混合溶液中Na+的浓度为( )
A.0.3 mol/L
B.0.45 mol/L
C.0.6 mol/L
D.0.15 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在18.6g Fe和Zn合金中加入200mL某浓度的稀硫酸恰好完全反应,生成0.3mol H2 . 则原合金中有mol Fe,稀硫酸的物质的量浓度为 mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )
A.加等量的水后硫酸中水电离出的c(H+)与硫酸铝中水电离出的c(H+)的比值比稀释前的比值增大
B.a点溶液中有:c(H+)+c(Al3+)=c(OH﹣)+c(SO42﹣)
C.体积和pH都相同的稀硫酸和硫酸铝溶液与等浓度的NaOH反应,消耗NaOH的体积相等
D.b、c两溶液水电离出的c(OH﹣)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明SiO2是酸性氧化物的是 ( )
A.SiO2 + 3C = SiC + 2CO↑
B.SiO2 + 2NaOH = Na2SiO3 + H2O
C.SiO2 + 4HF = SiF4↑+ 2H2O
D.SiO2 + CaCO3 = CaSiO3 + CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、X为化学常见物质,它们的转化关系如图所示(反应条件未注明).请根据题中信息回答问题. 
(1)若A为单质,E为白色难溶物且既能溶于盐酸又能溶于C溶液,则
①D与X发生反应的离子方程式为;
②常温下pH=10的C溶液与D溶液中,水的电离程度大(填C或D).
(2)若A为离子化合物,B为不溶于碱的白色难溶物,E与水反应生成的浓溶液G遇C有白烟产生,则
①A的化学式为;
②等物质的量浓度的G溶液与C溶液等体积混合,混合液中的质子守恒式为: . (用微粒浓度表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com