
【题目】为了除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
![]()
判断BaCl2溶液已经过量的方法___________________________________________
第4步中加入Na2CO3溶液的目的是将溶液中的_____(填离子符号)转化为______(填化学式)沉淀而除去。
第6步中加入适量盐酸时发生反应的化学方程式_________________________________________
蒸发结晶时会用到下列仪器中的__________________(填仪器名称)

【答案】 取少量②中上层清液于试管中,向其中滴加BaCl2溶液,若无沉淀产生,则BaCl2溶液已过量 Ca2+、Ba2+ CaCO3、BaCO3 NaOH+HCl=NaCl+H2O,Na2CO3+2HCl=2NaCl+H2O+CO2↑ 蒸发皿
【解析】在粗盐提纯时,加入过量的氯化钡的目的是除去硫酸根离子,并将之除尽,氯化钡过量时,加入硫酸会产生白色沉淀,可以通过检验钡离子来确定氯化钡是否过量,所以取所得溶液的上层清液1~2滴于滴定板上,再滴入1~2滴BaCl2溶液,若溶液未变浑浊,表明BaCl2已过量;
粗盐的提纯第4步中,加入碳酸钠的作用是除去杂质离子Ca2+以及过量的Ba2+,通过离子反应Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓,生成沉淀CaCO3和BaCO3;
第6步中加入适量盐酸是为了将滤液中所含的过量NaOH和Na2CO3除去,发生反应的化学方程式为NaOH+HCl=NaCl+H2O,Na2CO3+2HCl=2NaCl+H2O+CO2↑;
粗盐提纯的步骤是溶解、过滤、蒸发、结晶,由步骤可推测用的仪器是铁架台、漏斗、烧杯、玻璃棒、蒸发皿和酒精灯,则需要下列仪器中的蒸发皿。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案科目:高中化学 来源: 题型:
【题目】下列两种气体的分子数一定相等的是 ( )
A. 质量相等密度不等的NO和C2H6 B. 等体积不等密度的CO和C2H4
C. 等温等体积的O3和N2 D. 等压等体积的N2和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法医常用马氏试砷法检验是否砒霜( As2O3)中毒,涉及的反应如下:
I:6Zn+As2O3+12HCl=6ZnCl2+2AsH3(砷烷)↑+3H2O
Ⅱ:2AsH3=2As(黑色砷镜)+3H2
(1)写出砷的基态原子价电子排布图______________。
(2)砷烷的空间结构为_______;砷烷中心原子杂化方式为________。
(3)砷烷同族同系列物质相关性质如下表:
NH3 | PH3 | AsH3 | SbH3 | |
熔点/℃ | -77.8 | -133.5 | -116.3 | -88 |
沸点/℃ | -34.5 | -87.5 | -62.4 | -18.4 |
从PH3→AsH3→SbH3熔沸点依次升高的原因是_________;NH3分子例外的原因是_______。
(4)第一电离能数据I(As)>I(Se),可能的原因是_____________。
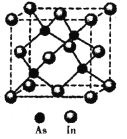
(5)砷与铟(In)形成的化合物(X)具有优良的光电性能,广泛应用于光纤通信用激光器,其晶胞结构如图所示,则其化学式为______;晶胞边长a= 666.67pm,则其密度为_____g/cm3(边长a可用![]() 近似计算,设NA=6.0×1023/mol)。
近似计算,设NA=6.0×1023/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
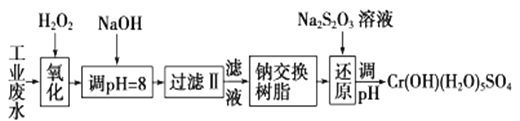
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | ll.l | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.HNO3 B.Na2O2 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________(填ABCD序号);已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是__________(填ABCD序号)。
A.Fe3+ B.Ca2+ C.Al3+ D.Mg2+
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-=Fe2+,阴极反应式是2H++2e-=H2↑。
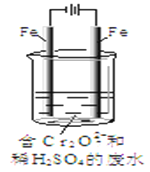
(3)电解时能否用Cu电极来代替阳极上的Fe电极?________(填“能”或“不能”),理由是______________。
(4)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期的A、B、C、D四种元素在周期表中均与元素X紧密相邻。已知元素X最高价氧化物的化学式为X2O5,B、D同主族且B元素的原子半径是同族元素中最小的,C的最高价氧化物对应的水化物是强酸。
(1)D元素基态原子的外围电子排布式为____________________。
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为________________(用相应的元素符号作答)。
(3)B、X、D氢化物的沸点由高到低的顺序为_______________(用相应的化学式作答)。
(4)C元素的原子可形成多种离子,试推测下列微粒的立体构型(C为字母,不是碳元素):
微粒 | CO32- | CO42- |
立体构型名称 | _______________ | _______________ |
(5)元素B的一种氢化物B2H4具有重要的用途。有关B2H4的说法正确的是_______。
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
(6)E元素和D元素在同一周期,属于VIII族,价层有三个单电子,E(OH)2为两性氢氧化物,在浓的强碱溶液中可形成E(OH)42-,写出E(OH)2酸式电离的电离方程式___________________。
(7)F元素基态原子M层上有5对成对电子,F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如图所示)中F原子的配位数之比为___________,δ、γ、α三种晶胞的边长之比为_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学物质在实际生产、生活和科技等方面的应用正确的是( )
A. 我国自主研发的“龙芯1号”CPU芯片与光导纤维是同种材料
B. 生产普通玻璃的主要原料有石灰石、石英和纯碱
C. 水晶项链和餐桌上的瓷盘都是硅酸盐制品
D. 玻璃上的漂亮花纹都依靠浓硫酸的腐蚀作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡桐素E的结构简式如图所示。下列说法正确的是

A. 该分子中有4个手性碳原子
B. 该分子中所有碳原子可处于同一平面
C. 1mol胡桐素E最多可与3molNaOH反应
D. 1mol胡桐素E最多可与4molH2发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com