
【题目】2008年5月,我国四川地区发生特大地震灾害,地震过后,饮用水的消毒杀菌成为抑制大规模传染性疾病暴发的有效方法之一。氯气(Cl2)是制备消毒剂的主要原料之一。工业上主要采用电解饱和食盐水的方法来制取Cl2。请回答下列问题:
(1)电解之前,食盐水需要精制,目的是除去粗盐的中的Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有:①Na2CO3溶液 ②Ba(OH)2溶液 ③稀盐酸。其中合理的加入顺序为___(填序号);
(2)实验室欲配制6.00 mol/L的食盐水90 mL,回答下列问题:
①需要纯净的NaCl___________________g。
②可供选择的仪器有:a玻璃棒 b烧瓶 c烧杯 d胶头滴管 e试管 f托盘天平、砝码 h药匙。在配制食盐水时不需要使用的有_______(填字母),还缺少的仪器是__________。
③配制溶液时,一般可以分为以下几个步骤:计算称量溶解(________________________)转移(_____________________)定容(__________________________)装瓶。
④下列操作会使所配溶液的浓度偏小的是___________________。
A. 转移完溶液后未洗涤玻璃棒和烧杯 B. 容量瓶中原来有少量蒸馏水
C. 定容时,俯视刻度线 D. 称量氯化钠固体时左码右物
(3)在电解饱和食盐水过程中,还生成了H2和NaOH,则所发生反应的化学反应方程式为_____________________________;
(4)将电解生成的Cl2通入NaOH溶液,生成两种盐,其中一种是消毒液的主要成分NaClO,应用氧化还原反应原理,写出此反应的化学方程式是_______________________。
【答案】 ②①③ 35.1 b e 100 ml容量瓶 冷却 洗涤 A D 摇匀 ![]()
![]()
【解析】(1)利用Na2CO3除去Ca2+,利用Ba(OH)2除去Mg2+和SO42-;为保证离子除尽,所加试剂都是过量的,所以要利用稀盐酸除去过量的CO32-和OH-;为除去过量的Ba2+,可以将Na2CO3在Ba(OH)2之后加入。所以加药品的顺序为:Ba(OH)2溶液、Na2CO3溶液、稀盐酸。
故答案为:②①③;
(2)①容量瓶只有一条刻度线,只能配制和其规格相对应的体积的溶液,所以要用100mL的容量瓶配制食盐水。m(NaCl)=c·V·M=6.00 mol/L×(100×10-3L)×58.5g/mol=35.1g。
故答案为:35.1;
②配制NaCl溶液的步骤是计算、称量、溶解、洗涤、定容、摇匀、装瓶,用到的仪器是:托盘天平、烧杯、玻璃棒、100ml容量瓶、胶头滴管;故不需要使用烧瓶和试管,还缺少100ml容量瓶。
故答案为:b、e;100ml容量瓶;
③配制NaCl溶液的步骤为:计算→称量→溶解→冷却→转移→洗涤→定容→摇匀→装瓶。
故答案为:冷却;洗涤;摇匀。
④A、转移完溶液,未洗涤玻璃棒和烧杯,会导致进入容量瓶的溶质偏少,所配溶液的浓度偏小,故A正确;B、容量瓶中原本有少量蒸馏水,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故B错误;C、定容时俯视刻度,会导致溶液体积偏小,则所配溶液的浓度偏大,故C错误;D、将砝码和物品的位置颠倒,由于使用游码,会导致所称量的药品的质量偏小,所配溶液浓度偏小,故D正确。
故选AD。
(3)饱和食盐水的成分为NaCl和H2O,在电解饱和食盐水过程中,生成了H2和NaOH,则H2O中H元素化合价降低。有化合价的降低,必有化合价的升高,则NaCl中Cl元素化合价由-1价升到0价。电解饱和食盐水的方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
故答案为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
(4)将Cl2通入NaOH溶液,生成两种盐,其中一种是NaClO,说明Cl2中Cl元素化合价由0价升高到NaClO中的+1价,则另外一种盐为化合价降低得到的盐,Cl2中Cl元素化合价降低为-1价,产物为NaCl。根据元素守恒,还有产物H2O。反应方程式为:Cl2+2NaOH=NaClO+NaCl+H2O。
故答案为:Cl2+2NaOH=NaClO+NaCl+H2O。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】钠、钾的碘化物在生产和科学实验中有十分重要的应用.工业利用碘、NaOH和铁屑为原料可生产碘化钠,其生产流程如图1: 
(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO.若NaOH溶液和碘反应时所得溶液中IO3﹣与IO﹣的物质的量之比为1:1,则该反应的离子方程式为 .
(2)生产流程中加入过量铁屑的目的是 , 过滤所得固体中除剩余铁屑外,还有红褐色固体,则加入铁屑时发生反应的化学方程式是 .
(3)溶液2中除含有H+外,一定含有的阳离子是;试设计实验证实该金属阳离子的存在 .
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O42H2O),称取3.60g草酸亚铁晶体(相对分子质量是180)用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图2所示:分析图中数据,根据信息写出过程Ⅰ发生2的化学方程式 .
②300℃时剩余固体只有一种且是铁的氧化物,试通过计算确定该氧化物的化学式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( ) 
A.该反应的△H=+91 kJmol﹣1
B.加入催化剂,该反应的△H变小
C.反应物的总能量小于生成物的总能量
D.如果该反应生成液态CH3OH,则△H减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是
①过滤、②蒸发、③溶解、④向容量瓶转移液体。
A.①和④B.①和③C.③和④D.①和②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙(CaH2)固体是登山运动员常用的能源提供剂.某兴趣小组拟选用如下装置制备氢化钙(原理为:H2+Ca ![]() CaH2).查阅资料可知:
CaH2).查阅资料可知:
①钙易与水反应生成碱和气体
②氢化钙要密封保存,接触到水就反应生成氢氧化钙和氢气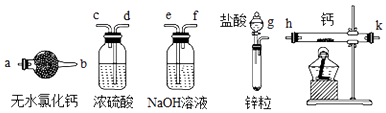
请回答下列问题:
(1)请从以上装置中选择合适的装置进行实验,请按气流方向连接顺序g→→→→→→k→a(填仪器接口的字母编号).
(2)写出该实验中制备氢气的离子方程式并标明电子转移的方向和数目
(3)无水氯化钙的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下Ksp(AgCl)=1.6×10﹣10、Ksp(AgI)=2.0×10﹣16 , 下列说法中正确的是( )
A.含有大量Cl﹣的溶液中肯定不存在Ag+
B.AgI悬浊液中加入少量KI粉末,平衡AgI(s)?Ag+(aq)+I﹣(aq)向左移动,溶液中离子的总浓度会减小
C.AgCl悬浊液中逐渐加入KI固体至c(I﹣)= ![]() mol?L﹣1时,AgCl开始向AgI沉淀转化
mol?L﹣1时,AgCl开始向AgI沉淀转化
D.向浓度均为0.01 mol?L﹣1的KCl和KI的混合溶液中滴加AgNO3溶液,当Cl﹣开始沉淀时,溶液中I﹣的浓度为1.25×10﹣8 mol?L﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com