
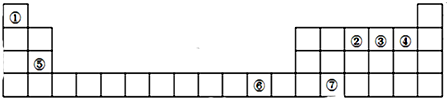

分析 根据元素在周期表中的位置知,①-⑦分别是H、N、O、F、Mg、Cu、Ge元素,
(1)⑦元素是Ge元素,其价电子为4s、4p电子,根据构造原理书写其价电子排布式;根据最后排入电子名称确定在周期表中的区域;
(2)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(3)根据价层电子对互斥理论确定碳原子杂化类型,非金属元素之间易形成共价键、含有空轨道的原子和含有孤电子对的原子之间易形成配位键;
(4)该晶胞中白色小球个数=8×$\frac{1}{8}$=1、黑色小球个数=12×$\frac{1}{4}$=3,两种小球个数之比为1:3,N元素为-3价,要使化合物中化合价的代数和为0知,则Cu应该为+1价,据此书写化学式.
解答 解:根据元素在周期表中的位置知,①-⑦分别是H、N、O、F、Mg、Cu、Ge元素,
(1)⑦元素是Ge元素,其价电子为4s、4p电子,根据构造原理书写其价电子排布式为4s24p2;根据最后排入电子名称确定在周期表中的区域,所以Cu属于ds区
故答案为:4s24p2;ds;
(2)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,这三种元素位于同一周期且N元素位于第VA族、O元素位于第VIA族、F元素位于第VIIA族,所以第一电离能大小顺序是F>N>O,
故答案为:F>N>O;
(3)该配合物中甲基碳原子价层电子对个数是4,则碳原子采用sp3杂化,碳碳双键两端的C原子价层电子对个数是3,则碳原子采用sp2杂化,非金属元素之间易形成共价键、含有空轨道的原子和含有孤电子对的原子之间易形成配位键,所以该配合物中C-C、C-H、C-N原子之间都存在共价键,Mg-N原子之间存在配位键,
故答案为:sp3、sp2;共价键、配位键;
(4)该晶胞中白色小球个数=8×$\frac{1}{8}$=1、黑色小球个数=12×$\frac{1}{4}$=3,两种小球个数之比为1:3,N元素为-3价,要使化合物中化合价的代数和为0知,则Cu应该为+1价,所以其化学式为Cu3N,
故答案为:Cu3N.
点评 本题考查物质结构和性质,涉及晶胞计算、原子杂化方式判断、化学键、电离能等知识点,这些都是高频考点,难点是晶胞计算,知道配位键的构成条件,注意配位键属于共价键.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LN2中σ键与π键个数比为1:2 | |
| B. | 反应物和生成物中只有氮气属于非电解质 | |
| C. | 该反应每转移1mol电子,有0.2molKNO3被氧化 | |
| D. | NaN3是只含离子键的离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器的总压强不随时间而变化 | |
| B. | 容器内气体的密度不再改变 | |
| C. | 单位时间内有nmolA2生成的同时有nmolB2消耗 | |
| D. | v正(A2)=2v逆(AB) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与硫酸的反应OH-+H+=H2O | |
| B. | 铝粉投入到NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com