
分析 (1)设ClO-与ClO3-的物质的量为1mol、1mol,此时失去的电子的物质的量为6mol,根据得失电子数相等,生成的Cl-为6mol,那么被还原的氯元素为6mol,据此书写方程式,根据化合价的升降计算反应中氧化剂和还原剂的物质的量之比;
(2)根据公式c=$\frac{n}{V}$来计算即可.
解答 解:(1)设ClO-与ClO3-的物质的量为1mol、1mol,此时失去的电子的物质的量为6mol,根据得失电子数相等,生成的Cl-为6mol,那么被还原的氯元素为6mol,根据电荷守恒得到反应为:4Cl2+8OH-=ClO-+ClO3-+6Cl-+4H2O,反应中氧化剂和还原剂的物质的量之比是3:1,故答案为:4Cl2+8OH-=ClO-+ClO3-+6Cl-+4H2O;3:1;
(2)根据反应:4Cl2+8OH-=ClO-+ClO3-+6Cl-+4H2O,标准状况下33.6L Cl2的物质的量是1.5mol,消耗氢氧化钠是3mol,所用NaOH溶液的浓度c=$\frac{n}{V}$=$\frac{3mol}{0.5L}$=6mol/L,故答案为:6.
点评 本题考查学生氧化还原反应电子转移的计算以及方程式的书写和物质的量浓度的计算知识,属于综合知识的考查,难度不大.


科目:高中化学 来源: 题型:解答题
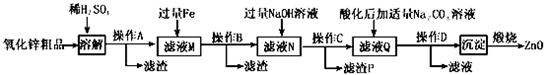
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
| pH | 3.2 | 6.7 | 8.0 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH | B. | CH3COOCH2CH3 | C. | CH2=CHCOOH | D. | 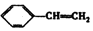 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
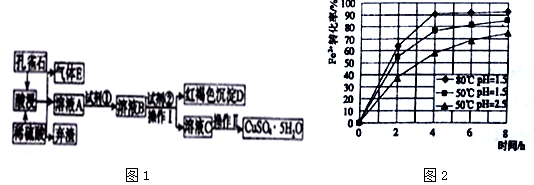
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 4.7 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaBiO3 | B. | Na4XeO6 | C. | K2S2O8 | D. | PbO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
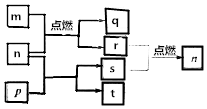 短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( )| A. | Y、Z、W的简单离子的电子层结构相同 | |
| B. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| C. | 简单氢化物的稳定性:X>Y | |
| D. | Y与Z两种元素形成的化合物一定只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
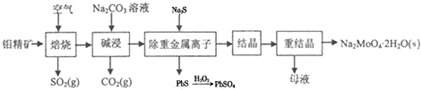
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
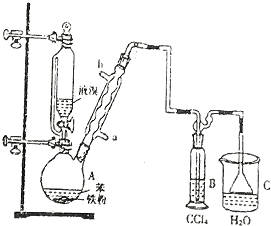
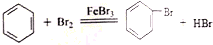 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com