
| A、含0.2mol H2SO4的浓硫酸与足量锌反应,生成气体的分子数小于0.1NA |
| B、标况下,22.4L四氯化碳所含分子数大于NA |
| C、0.1mol/L 的AgNO3溶液中,阳离子所带正电荷数目为0.1NA |
| D、标准状况下,11.2L HF含有的HF分子数为0.5NA |


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
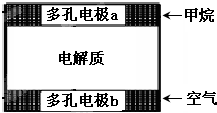 一种根据燃料电池原理设计瓦斯分析仪工作原理如右图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动并与CO2结合为CO32-.下列有关叙述正确的是( )
一种根据燃料电池原理设计瓦斯分析仪工作原理如右图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动并与CO2结合为CO32-.下列有关叙述正确的是( )| A、电极a反应式为:CH4+5O2--8e-=CO32-+2H2O |
| B、电极b是正极,O2-由电极a流向电极b |
| C、瓦斯分析仪工作时,电池内电路中电子由电极a流向电极b |
| D、当固体电解质中有1mol O2-通过时,电子转移4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存 |
| B、在甲、乙两烧杯的溶液中,共含有Cu2+、K+、H+、Cl-、CO32-、OH-六种离子.已知甲烧杯的溶液含其中3种离子并呈蓝绿色,则乙烧杯的溶液中含有的3种离子是K+、OH-、CO32- |
| C、在含有HCO3-、SO32-、S2-、CH3COO-四种阴离子的溶液中加入足量的Na2O2固体后,CH3COO-浓度变化最小 |
| D、常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、S2-、NH4+不能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:3 | B、3:2 |
| C、1:3 | D、1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有阴离子的化合物一定含有阳离子,含有阳离子的化合物不一定含有阴离子 |
| B、只含化学键而无分子间作用力的化合物晶体一定是原子晶体 |
| C、质子数和电子数均相同的两种微粒不可能是一种分子和一种离子 |
| D、只有分子中所有原子均达到2个或8个电子稳定结构的分子才是稳定分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(N2)正=v(NH3)逆 |
| B、单位时间内3molH-H键断裂,同时6mol N-H键断裂 |
| C、n(N2):n(H2):(NH3)=1:3:2 |
| D、反应混合物各组分的物质的量浓度还在改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM2.5是指大气中直径小于或等于2.5微米的颗粒物,在空气中能产生丁达尔现象 |
| B、在海轮外壳上镶嵌锌块,会减缓船体的锈蚀 |
| C、经过必要的化学变化能从海水中提取NaCl、Mg、Br2等物质 |
| D、大量燃烧化石燃料排放的废气中大量CO2、SO2,造成大气污染,从而使雨水的PH=5.6形成酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:
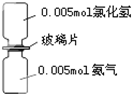 如图是氨气与氯化氢反应的装置.抽走玻璃片充分反应,反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( )
如图是氨气与氯化氢反应的装置.抽走玻璃片充分反应,反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( )| A、气体反应物的总体积为0.224L |
| B、产物中所含的N-H键个数为0.02NA |
| C、生成物中含有0.005NA个分子 |
| D、加1L水溶解后所得溶液中阳离子浓度为0.005mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com