
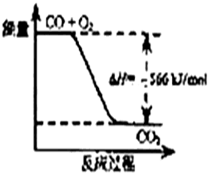
| A. | CO的燃烧热为283 kJ/mol | |
| B. | 图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| D. | CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为1.204×1024 |
分析 A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
B.由热化学方程式可知,1molCO完全燃烧放出热量283kJ;
C.在反应物和生成物状态不变情况下,△H与n成正比,气态变为固态时放热;
D.已知:①2CO(g)+O2(g)=2CO2(g);△H=-566kJ/mol
②Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g);△H=-226kJ/mol
根据盖斯定律,②×2+①可得:2CO(g)+2Na2O2(s)=2 Na2CO3(s)△H=-1018kJ/mol,根据反应计算参加反应CO物质的量,再根据C元素化合价变化计算转移电子.
解答 解:A.由2CO(g)+O2(g)═2CO2(g);△H=-566kJ/mol可知,CO的燃烧热为$\frac{1}{2}×$566kJ/mol=283kJ/mol,故A正确;
B.由热化学方程式可知,1molCO燃烧放出热量为283kJ,图象中的焓变应是2molCO燃烧的反应热,图象中物质的量和焓变不统一,故B错误;
C.2Na2O2(s)+2CO2(g)═2Na2CO3(s)+O2(g)△H=-452 kJ/mol,气态变为固态时放热,因此2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H=>-452 kJ/mol,故C正确;
D.已知:①2CO(g)+O2(g)=2CO2(g);△H=-566kJ/mol
②Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g);△H=-226kJ/mol
根据盖斯定律,②×2+①可得:2CO(g)+2Na2O2(s)=2 Na2CO3(s)△H=-1018kJ/mol,CO(g)与Na2O2(s)反应放出509kJ热量时,参加反应CO为2mol×$\frac{509kJ}{1018kJ}$=1mol,反应的电子转移数为2mol,即电子转移数为1.204×1024,故D正确,
故D;
故选B.
点评 本题考查燃烧热、热化学方程式、反应热计算、盖斯定律应用等,难度中等,注意对基础知识的理解掌握,有利于基础知识的巩固.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒容密闭容器中进行的反应3A(g)?B(g)+c(g),在其他条件不变的情况下,再充入一定量的A气体,A的转化率将增大 | |
| B. | 对于可逆反应N2(g)+3H2(g)?2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增加 | |
| C. | 将FeCl3溶液和NaAlO2溶液相混,所得固体产物Fe(OH)3 | |
| D. | 反应NH3(g)+HCl(g)?NH4Cl(s)△H<O在任何条件下均能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解度(s) | B. | 物质的量浓度(c) | C. | 质量分数(w) | D. | 摩尔质量(M) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2溶液中通入Cl2:Fe2++Cl2═Fe3++2Cl- | |
| B. | Mg(OH)2与盐酸的反应:OH-+H+═H2O | |
| C. | Al(OH)3沉淀中滴加盐酸:Al(OH)3+3H+═Al3++3H2O | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
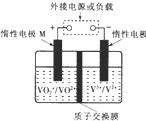 全钒液流储能电池利用不同价态离子对的氧化还原反应来实现化学能和电能的相互转化,充电时,惰性电极M、N分别连接电源的正极和负极.电池工作原理如图所示,下列说法不正确的是( )
全钒液流储能电池利用不同价态离子对的氧化还原反应来实现化学能和电能的相互转化,充电时,惰性电极M、N分别连接电源的正极和负极.电池工作原理如图所示,下列说法不正确的是( )| A. | 充电过程中,N电极附近酸性减弱 | |
| B. | 充电过程中,N电极上V3+被还原为V2+ | |
| C. | 放电过程中,H+由N电极向M电极移动 | |
| D. | 放电过程中,M电极反应为V02++2H++e-═V02++H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
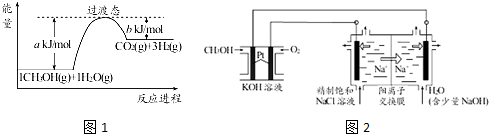
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极发生的反应为:Fe-3e-═Fe3+ | |
| B. | 正极发生的反应为:2H2O+O2+2e-═4OH- | |
| C. | 原电池是将电能转变为化学能的装置 | |
| D. | 钢柱在水下部分比在空气与水交界处更难腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com