
下列实验方案不能达到实验目的的是( )
| 实验目的 | 实验方案 | |
| A | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2 mL 1 mol·L-1NaOH溶液中先加入3滴1 mol·L-1MgCl2溶液,再加入3滴 1 mol·L-1FeCl3溶液 |
| C | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入足量稀NaOH溶液,再向其中加入新制的银氨溶液,并水浴加热 |
| D | 探究温度对化学平衡的影响 | 将NO2球浸泡在冷、热水中,观察颜色的变化 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
一定温度下,pH=a的某电解质溶液中,插入两支惰性电极 通直流电一段时间后,溶液的pH<a,则该电解质可能是
通直流电一段时间后,溶液的pH<a,则该电解质可能是
A. NaCl B.H2SO4 C.CuCl2 D. Na2SO4
D. Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,将Na与O2反应的生成物1.5g溶于水,所得溶液恰好能被80mL浓度为0.5 mol/L的HCl溶液中和,则该生成物的成分是
A.Na2O B.Na2O2 C.Na2O和Na2O2 D.Na2O2和NaO2
查看答案和解析>>
科目:高中化学 来源: 题型:
运用下列装置和操作能达到实验目的和要求的是( )
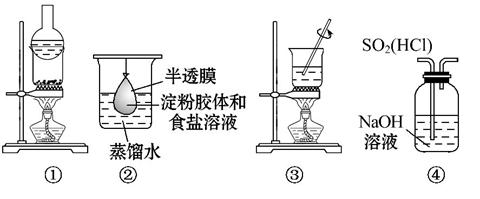
A.用①分离氯化铵和单质碘
B.用②除去淀粉溶液中的氯化钠
C.用③加热胆矾(CuSO4·5H2O)制取无水硫酸铜
D.用④装置除去SO2中的HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验设计能够成功的是( )
A.检验亚硫酸钠试样是否变质:
试样 溶液
溶液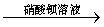 白色沉淀
白色沉淀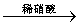 沉淀不溶解
沉淀不溶解
B.除去乙酸乙酯中混有的乙酸:
混合液 溶液分层
溶液分层 得上层液体
得上层液体
C.证明酸性条件下H2O2氧化性比I2强:
NaI溶液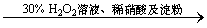 溶液变蓝色
溶液变蓝色
D.鉴定盐A的成分是FeBr2:
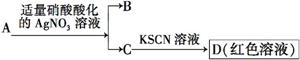
查看答案和解析>>
科目:高中化学 来源: 题型:
化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验,回答相关问题。
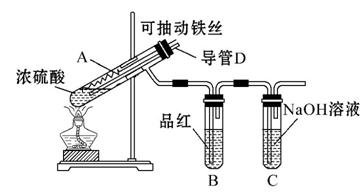
(1)用“可抽动铁丝”代替“直接投入铁片”的优点是____________
(2)能说明有SO2气体产生的实验现象是___________ _
(3)反应后,不需要打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是______ ______
(4)反应一段时间后,他们对A中溶液的金属离子进行探究,请完成相关问题。
①提出假设:
假设1:只含有Fe3+;
假设2: ___ _________;
假设3:既有Fe2+,又有Fe3+。
②设计实验方案验证假设3。写出实验步骤、预期现象和结论。
限选试剂及仪器:稀硫酸、KMnO4溶液、NaOH溶液、淀粉-KI溶液、H2O2溶液
| 实验步骤 | 预期现象和结论 |
| 步骤一:用胶头滴管取A试管中的溶液,用水稀释并分装试管Ⅰ、Ⅱ备用 | |
| 步骤二:往试管Ⅰ中, ____________ | |
| 步骤三: |
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下2 L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示。下列说法正确的是( )
| X | Y | W | |
| n(起始状态)/mol | 2 | 1 | 0 |
| n(平衡状态)/mol | 1 | 0.5 | 1.5 |
A.该温度下,此反应的平衡常数K=6.75
B.升高温度,若W的体积分数减小,则此反应ΔH>0
C.增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D.该温度下,此反应的平衡常数表达式是
K=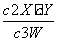
查看答案和解析>>
科目:高中化学 来源: 题型:
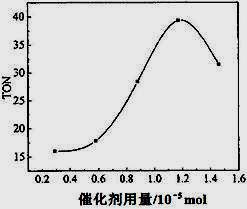 碳酸二甲酯(DMC)是一种近年来受到广泛关注的环保型绿色化工产品。在催化剂作用下,可由甲醇和CO2直接合成DMC:CO2 + 2CH3OH → CO(OCH3)2 + H2O,但甲醇转化率通常不会超过1%是制约该反应走向工业化的主要原因。某研究小组在其他条件不变的情况下,通过研究温度、反应时间、催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果。计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量。
碳酸二甲酯(DMC)是一种近年来受到广泛关注的环保型绿色化工产品。在催化剂作用下,可由甲醇和CO2直接合成DMC:CO2 + 2CH3OH → CO(OCH3)2 + H2O,但甲醇转化率通常不会超过1%是制约该反应走向工业化的主要原因。某研究小组在其他条件不变的情况下,通过研究温度、反应时间、催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果。计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量。
(1)已知25℃时,甲醇和DMC的标准燃烧热分别为△H1和△H2,则上述反应在25℃时的焓变△H3=___________。
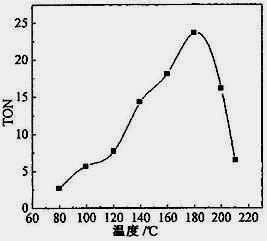
(2)根据反应温度对TON的影响图(下左图)判断该反应的焓变△H________0(填“>”、“=”或“<”),理由是________________________________。
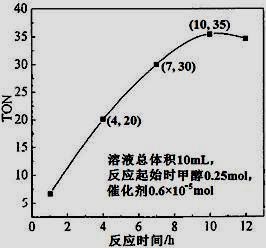
(3)根据反应时间对TON的影响图(上右图),已知溶液总体积10mL,反应起始时甲醇0.25mol,催化剂0.6×10—5 mol,计算该温度下,4~7 h内DMC的平均反应速率:________;计算10 h时,甲醇的转化率:________。
(4)根据该研究小组的实验及催化剂用量对TON的影响图(左图),判断下列说法正确的是___ __。
a. 由甲醇和CO2直接合成DMC,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义
b. 在反应体系中添加合适的脱水剂,将提高该反应的TON
c. 当催化剂用量低于1.2×10—5 mol时,随着催化剂用量的增加,甲醇的平衡转化率显著提高
d. 当催化剂用量高于1.2×10—5 mol时,随着催化剂用量的增加,DMC的产率反而急剧下降
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com